錯イオンは一見複雑で、
しかも沈殿と絡んで習うために、
反応をきちんと理解している人が少ないです。
あなたもただただ丸暗記になっていませんか?
この記事では、
錯イオン形成反応を仕組みから説明します。
「なぜ錯イオンなんかができるのか」
「錯イオンはどうやって生成されるのか」
などが、すっきりと理解できるでしょう。
もちろん錯イオンの形や命名法など、
基礎的な内容もまとめたので、
ぜひ最後まで読んでみてください。
目次 [hide]
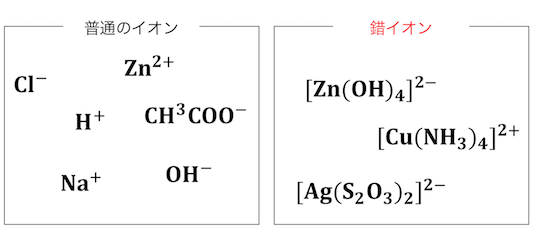
錯イオンとは
配位結合や水素結合などによって、
1つにまとまっている分子のことを「錯体」といいます。
そして錯体の中でも、
金属イオンに分子や陰イオンが配位して、
イオンの状態になっているものを「錯イオン」といいます。
錯イオンを英語で書くと”complex ions”です。
つまり錯イオンとは単に、
「いつも見るイオンより複雑なイオン」
という意味になります。
錯イオン形成反応の仕組み
錯イオンはどのように作られるのでしょうか?
錯イオンが生成される仕組みを考えてみます。
金属イオンの正体
錯イオンが作られる仕組みを考えるには、
金属イオンについて考え直さなければいけません。
さてここで、
「熱化学方程式」のときに考える、
エネルギー図を思い出してみましょう。
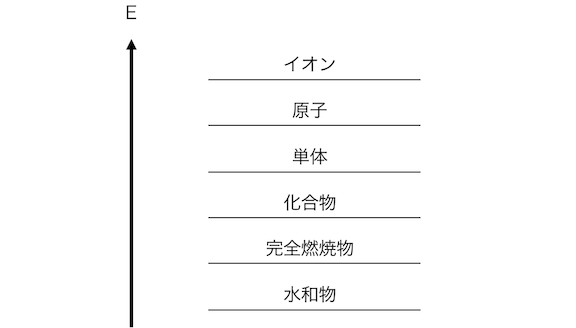
イオンは相当エネルギーが高い状態です。
単体や化合物の状態から原子を引き剥がし、
その原子からさらに電子を引き剥がす必要がありますからね。
そう考えると、
金属がイオンの状態になっているのは、
かなり不思議ですね。
しかし今回は金属イオンは、
極性溶媒である水の中にいます。
金属イオンは、
水に取り囲まれて「水和」しているからこそ、
金属イオンとして存在できているんです。
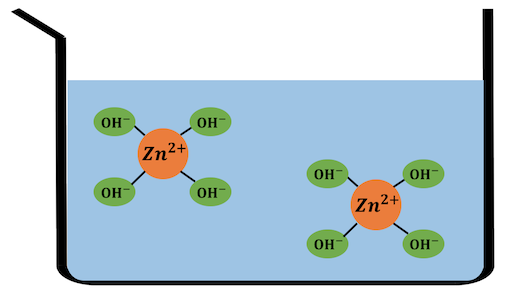
例えば亜鉛イオンZn2+は、
水溶液中では以下のようになっています。
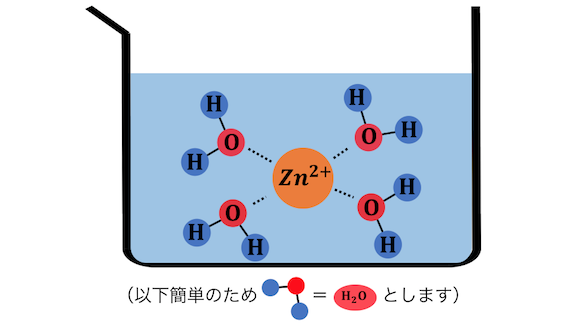
これを化学式で書くと、[Zn(H2O)4]2+。
実は金属イオンが水に溶けているとは、
水との錯イオンを作っていると言い換えることができるわけです。
配位子の水は書かないルールになっています。
錯イオン形成反応=配位子交換反応
金属イオンが水に溶けているとき、
そもそも金属には水が配位しているのでした。
ではその亜鉛イオンZn2+に対して、
水酸化ナトリウムを入れてみましょう。
Zn2+とOH–のイオン積が小さいため、
配位した水を追い出してZn(OH)2沈殿を作ります。
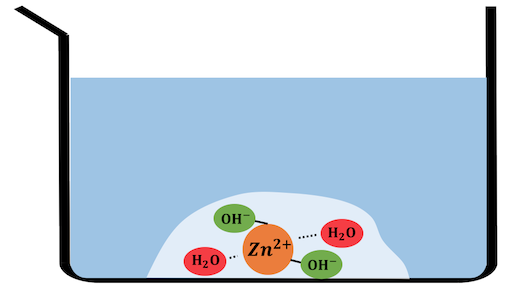
ここにさらに多量の水酸化ナトリウムを入れていきます。
すると大量のOH–によって水がさらに追い出され、
[Zn(OH)4]2-という錯イオンが生成されます。
以上の反応をまとめると、
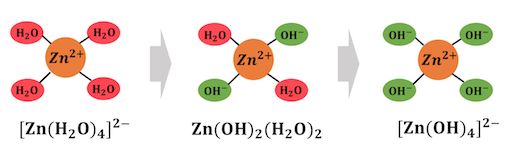
複雑に見えた錯イオンの生成反応も、
単に配位子が交換されていくだけだったのです。
以上のことから錯イオン形成反応は、
「配位子交換反応」と呼ぶこともできます。
錯イオンの形
次に錯イオンの形を確認していきます。
錯イオンは配位子の数(配位数)などによって、
直線型、正四面体型、正方形型、正八面体型
など様々な形をとります。
錯イオンの形には「配位数」が大きく影響しています。
まずは配位数から確認しましょう。
配位数
金属イオンに配位できる分子や陰イオンの数を「配位数」といいます。
金属イオンの配位数は、
様々な要因に左右されます。
しかし高校範囲ではほとんどの配位数は、
「金属イオンの価数の最大値×2」
となっています。
化学的、物理的根拠はありませんが、
暗記には役立つと思います。
配位数をまとめると以下のようになります。
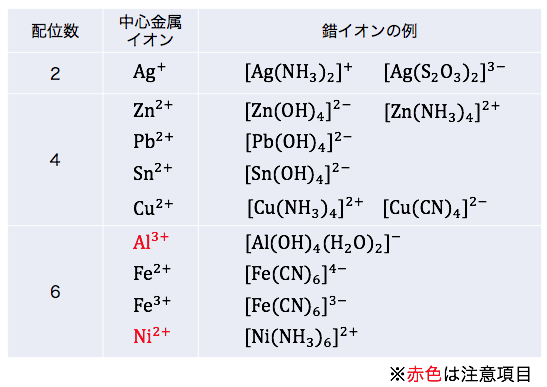
ただし2つだけ注意点があります。
① Al3+
学校では[Al(OH)4]–と習いますが、
実は[Al(OH)4(H2O)2]–が正確な形です。
「配位した水は書かない」というルールのせいで隠れていただけです。
となるとやはりAl3+の配位数は6ですね。
② Ni2+
2価のイオンに対して配位数6を取ります。
先ほどの暗記法の例外です。
ただし入試で暗記を求められることはないでしょう。
① 金属イオンの電荷
② 金属イオンのd電子数(参照:軌道理論)
③ 配位子の反発
④ 配位子の結合の強さ
などと複雑で、これが綺麗に体系化できない理由です。
例えばCo2+は[Co(NH3)6]2+を作りますが、
弱い配位子のCl–が配位すると[Co(Cl)4]2-と配位数が4になります。
錯イオンの形(VSEPR則)
配位数がわかったので、
次に錯イオンの形を見ていきます。
錯イオンに限った話ではありませんが、
分子の形はVSEPR則によって決まります。
VSEPR則は原子価殻電子対反発則の略で、
「原子を取り囲む価電子がお互いに反発して、
一番遠い場所に向かう」
という考え方です。
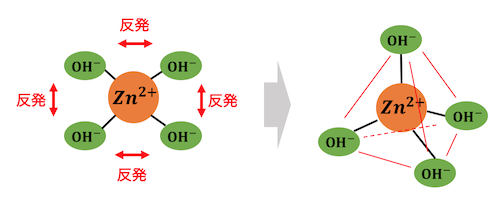
VSEPR則を考えれば、
配位数が2であれば直線型、
配位数が4であれば正四面体型、
配位数が6であれば正八面体型、
となることがわかりますね。
わざわざ暗記する必要はなさそうです。
ただし1つだけ例外があるので注意。
銅は配位数が4の錯イオンを作りますが、
その構造は「正方形型」になります。
これには複雑な理由が関わっているのですが、
ここではVSEPR則の例外として覚えておきましょう。
以上を踏まえて
先ほどの表を整理すると以下のようになります。
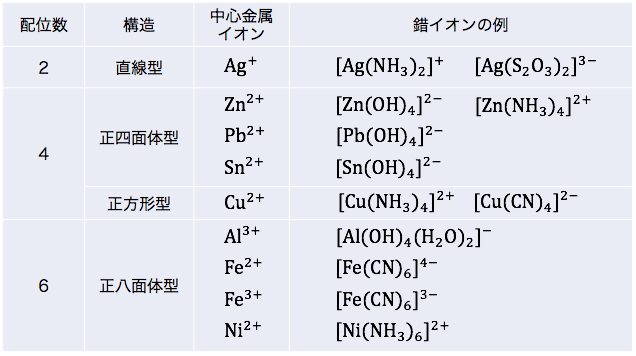
OH–のみに着目すると正方形になります。
大学の錯体の授業で理由を勉強するので、
その時を楽しみにしていましょう。
錯イオンの命名法
命名法
錯イオンの命名法についてもまとめておきます。
錯イオンの名付け方は以下の通り。
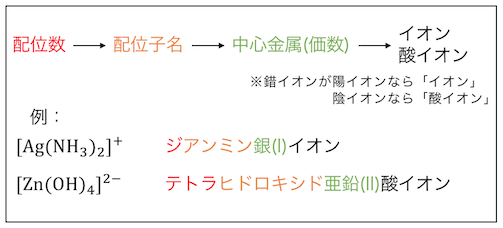
配位数はギリシャ語で数え、
配位子も慣用的に呼び方が決まっています。
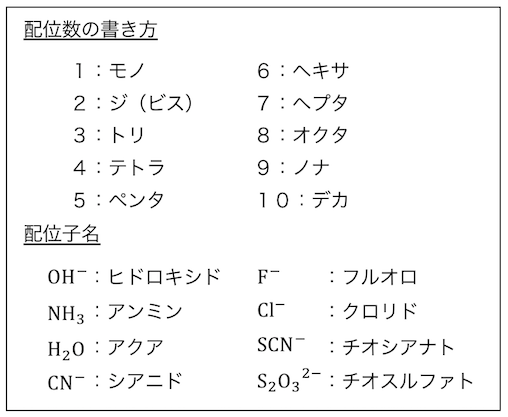
錯イオンの名前は一見複雑ですが、
ルール通り考えれば簡単ですね。
金属イオンのうち、「アルミニウム(Ⅲ)」は「アルミン」と呼びます。
練習問題
せっかく命名法を学んだので、
少し練習をしておきましょう。
(1)[Zn(OH)4]2-
(2)[Al(OH)4]–
(3)[Cu(NH3)4]2+
(4)[Ag(NH3)2]+
(5)[Fe(CN)6]4-
(6)[Ag(S2O3)2]3-
先ほどの表を見ながらでも大丈夫です。
自分で調べながらでもやってみるというのが大切です。
(1)[Zn(OH)4]2-
テトラヒドロキシド亜鉛(Ⅱ)酸イオン
(2)[Al(OH)4]–
テトラヒドロキシドアルミン酸イオン
アルミンで「アルミニウム(Ⅲ)」という意味を含んでいることに注意です。
(3)[Cu(NH3)4]2+
テトラアンミン銅(Ⅱ)イオン
(4)[Ag(NH3)2]+
ジアンミン銀(Ⅰ)イオン
(5)[Fe(CN)6]4-
ヘキサシアニド鉄(Ⅱ)酸イオン
錯イオンの価数から鉄が2価とわかります。
(6)[Ag(S2O3)2]3-
ビスチオスルファト銀(Ⅰ)酸イオン
「ジチオスルファト」でも間違いではありません。慣習的にこのように呼びます。
まとめ
今回は錯イオンについて勉強しました。
「配位子が交換されてるだけだったなんて!」
と思っている人も多いのではないでしょうか。
反応の物理的なイメージがついた方が、
暗記もしやすいですね。
また、
「配位数は原則金属イオンの最大価数の2倍」
「例外はNi2+とCu2+。Al3+も注意。」
「錯イオンの形はVSEPR則で決まる」
と整理して理解しておきましょう。
命名法だけは少し暗記が多いので、
ぜひ繰り返し記事を確認してください。













表のヘキサシアニド鉄(Ⅲ)酸イオンの鉄イオンが \rm Fe^{2-} になってます!
わ、ほんとですね
ご指摘ありがとうございます、直しておきました!
例えば、銅Ⅱイオンはアンモニアを4個まで配位して錯イオンになれるのに、水酸化物イオンを4個まで配位して錯イオンになれないのはなぜですか?
錯イオンができるかどうかは、
さまざまな要因によって決まるため、
一言で説明するのは難しいです…。
例えば、高校生風に説明するなら、
・金属の電子配置がどうなっているか
・配位子の電気陰性度はどう影響するか
・配位子の立体構造はどう影響するか
などです。
これらすべてをきちんと計算すれば、
錯イオンを作るペアは計算できますが、
そんな計算をするのは現実的ではないですね。
だから残念ながら、
金属イオンと配位子の組み合わせに、
直感的な理由をつけることは難しく、
覚えておくしかありません。
ただ、「覚えろ!」で終わるのも味気ないので、
なんとなく大学化学の雰囲気がわかるように、
簡単な補足だけはしておきますね。
興味がなければ無視しちゃっていいです。
この記事では、
金属には配位子が座るための椅子があって、
そこに配位子が座る、というイメージで説明しました。
でも実は、実際には、
配位子が座る椅子の配置は、
配位子の種類によって変化するのです。
例えば痩せた人ばかりなら6人座れるけど、
太った人ばかりだと4人しか座れないし、
あまりに太った人は体重制限で座れません。
身近な錯イオンの例では、
CuはNH3と正方形型の錯イオンを作りますが、
Clとは正四面体型の錯イオンを作ったりもします。
ほんとは結構複雑なことが起こってるんですね。
このような金属と配位子の相互作用は、
大学物理の基礎科目「量子力学」によって計算されます。
今の段階では、以上の「ごまかし」みたいな説明しかできなくてすいません、
ぜひ大学では量子力学やそれを化学に応用する物理化学の分野を学んでみてください。
スズの最大価数は4プラスのような気がするんですが…
[Sn(OH)6]2-があるので。
確かにそうですね、Sn2+→Sn4++2e–という還元剤としての反応もありますしね。
盲点になってました、ご指摘ありがとうございます!
訂正しておきます〜
アクア錯イオンについての質問です。
ミョウバン、AlK(SO₄)₂・12H₂Oが水に溶かすと弱酸性になる理由を問う問題で
解説にはこれらを溶解させたイオンのうちAl³⁺が[Al(H₂O)₆]³⁺になり、Alに配位しているH₂O分子がOH⁻に部分的に変化して放出されたH⁺が酸性を示すとありました。
これがなぜなのかと他のイオンが影響しない理由を教えてください。
結論から言えば、強酸H2SO4と弱塩基Al(OH)3+強塩基KOHの塩だからです。強酸と弱塩基の塩は酸性となります。
仕組みは塩化アンモニウムが酸性になるのと同様で、加水分解が起こるからです。Al3+はOH–との電離度が低すぎるので、水が発するOH–とすら結合してしまい、残ったH+のせいで酸性となります。
またK+は強塩基由来なので、液性に影響は与えません。