今回は熱分解反応の解説をします。
化学反応には全て理由があります。
酸化還元反応は、
電子が欲しいやつが電子を奪い、
電子が捨てたいやつが電子を投げる反応、
弱酸・弱塩基の遊離反応や沈殿生成反応は、
化学平衡の原理を利用した反応でした。
熱分解反応の原理は単純で、
「熱のエネルギーで無理やり反応を起こす」
ということになります。
原理はわかりやすいですが、
その分反応の生成物の予想が難しいです。
熱分解反応の反応式を作るためには、
生成物を暗記していくしかないということです。
そこでこの記事では、
熱分解反応で覚えておくべき生成物を、
入試レベル的に過不足なく、できるだけわかりやすくまとめます。
生成物の予想が難しいとは言いましたが、
完全な丸暗記にはならないように、
できる限り反応の仕組みも説明します。
まとめて覚えておく方が良いので、
ぜひ最後まで見ていってください。
目次
熱分解反応の生成物
まずは生成物のまとめ表を作っておきます。
細かい仕組みに興味がなければ、
この表だけを覚えておけば問題ありません。
① 炭酸塩の熱分解
炭酸塩 → 金属酸化物 + CO2
例:CaCO3 → CaO + CO2
(例外:アルカリ金属塩)
②炭酸水素塩の熱分解
炭酸水素塩 → 炭酸塩 + CO2 + H2O
例:Ca(HCO3)2 → CaCO3 + CO2 + H2O
2NaHCO3 → Na2CO3 + CO2 + H2O
③金属水酸化物の熱分解
金属水酸化物 → 金属酸化物 + H2O
例:Cu(OH)2 → CuO + H2O
(例外:アルカリ金属水酸化物)
④カルボン酸塩の熱分解
カルボン酸塩 → CO2 + (金属酸化物など)
例:(COO)2Ca → CO2 + CaO + CO
⑤その他の熱分解
2KClO3 → 2KCl + 3O2 (MnO2触媒)
2H2O2 → 2H2O + O2 (MnO2触媒)
NH4NO2 → 2H2O + N2
HCOOH → H2O + CO(濃硫酸)
スマホの1画面に収まるようになっているので、
スクショをしておくと便利です。
それでは順番に説明していきますね。
① 炭酸塩の熱分解
例:CaCO3 → CaO + CO2
(例外:アルカリ金属塩)
陽性の金属イオンと電気陰性度の強い酸素が、
強いイオン結合を作り
生成物が安定であるために反応が起こります。
金属の陽性の度合いが関係するため、
例えば同じ2族なら原子半径が小さい方が、
分解反応が進みやすいです。
1価で陽性が小さく原子半径も大きいからです。
② 炭酸水素塩の熱分解
例:Ca(HCO3)2 → CaCO3 + CO2 + H2O
2NaHCO3 → Na2CO3 + CO2 + H2O
中学生のときに、
「石灰水に二酸化炭素を通すと濁り、
さらに通すと透明になる」
というのがありましたね。
ここで起こっている反応は以下の通りです。
化学平衡は、
「エネルギーを放出する力」
「バラバラになろうとする力」
で成り立っていました。
温度を上げると一般によりバラバラになるため、
平衡が左に進んで反応が進みます。
【合わせてチェック】
・絶対にわかる化学平衡の仕組み
③ 金属水酸化物の熱分解
例:Cu(OH)2 → CuO + H2O
(例外:アルカリ金属水酸化物)
OH–同士が水素結合で近づき、
それが熱によって追い出された、
と覚えておけばよいでしょう。
より詳しくは金属酸化物のあたりを復習しておきましょう。
④カルボン酸塩の熱分解
例:(COO)2Ca → CO2 + CaO + CO
一般にカルボン酸塩は熱分解により炭酸塩になりやすいです。
無機化学の単元ではありますが、
有機化学の反応も少し紹介しておきます。
(CH3COO)2Ca → CaCO3 + CH3COCH3
⑤ その他の熱分解
2H2O2 → 2H2O + O2 (MnO2触媒)
NH4NO2 → 2H2O + N2
HCOOH → H2O + CO(濃硫酸)
2KClO3 → 2KCl + 3O2 (MnO2触媒)
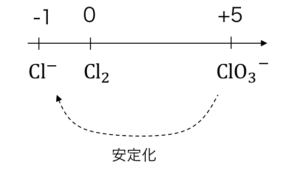
より安定な酸化数へ変化するために、
分子内で酸化還元反応が発生しています。
2H2O2 → 2H2O + O2 (MnO2触媒)
H2Oは構造的な意味でも、
集合したときの水素結合的な意味でも安定です。
不安定なH2O2から、
総合的に見て安定な形に変化したと考えることができます。
NH4NO2 → 2H2O + N2
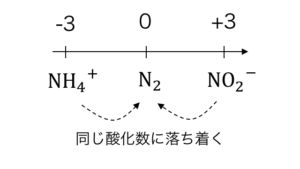
分子内で異なる酸化数だった同一原子が、
同じ酸化数に落ち着くために、
分子内で酸化還元反応が発生しています。
HCOOH → H2O + CO
濃硫酸で無理やり脱水される、
というイメージで問題ないでしょう。
分子内で酸化還元反応が起こるので、
「自己酸化還元反応」と呼ばれることもあります。
おまけ・注意点
熱分解とは違いますが、
以下のような反応も勉強しましたね。
ハロゲン化銀の光分解です。
熱分解ではありませんが、
受験の知識としては必須なので覚えておきましょう。
また、以下のような水和物関係も、
物理的な変化に近いためのぞきました。
最後に注意点ですが、
今回はあくまで入試レベルとしてまとめています。
加熱の仕方によっては、
「まじか!」という反応も起こってしまいます。
→ CaSO4・H2O(150℃)
→ CaSO4(300℃)
→ CaO + SO3(900℃)
あくまで「受験知識」として押さえておいてください。
まとめ
お疲れさまでした。
今回は暗記前提だったので、
逆に素直に読めたかもしれません。
ただしその分、
暗記は何度も復習することも前提になってくるので、
生成物のまとめを何度も見直してください。














コメントを書く