あなたは工業的製法で、
「どうしてこんな反応になるの?」
「なんでわざわざこんな手順をとるの?」
「この反応の触媒はなんだっけ…」
などと思ったことはありませんか?
工業的製法は複雑な手順であることも多く、
さらに覚えるべき言葉も多いです。
「反応の理由」を考えずに丸暗記しようとしては、
複雑な手順を覚えることは不可能です。
この記事では高校で習う工業的製法をまとめました。
ここの内容をしっかりと読むことで、
もう工業的製法で迷うことはなくなります。
センター試験などで無駄な時間がかからず、
無機化学の分野は「瞬殺」できてしまうでしょう。
それでは順番に見ていきます。
工業的製法まとめ
無機化学の工業的製法は以下の通り。
①アンモニアソーダ法
②接触法
③オストワルト法
④ハーバーボッシュ法
⑤アルミニウムの製法
⑥鉄の製法
⑦銅の製法
①アンモニアソーダ法
アンモニアソーダ法は、
アンモニアから炭酸ソーダ(Na2CO3)を作る方法。
Na2CO3を作るためには、
「沈殿生成反応」と「熱分解反応」を利用します。
2NaHCO3→Na2CO3+H2O+CO2
HCO3–を作るためにCO2を水に溶かしたいですが、
溶解度が小さくあまり溶けません。
そこにアンモニアをいれることで、
「中和反応」を利用してHCO3–を作ります。
以上をまとめると、
2NaHCO3→Na2CO3+H2O+CO2
これが反応のキモです。
より詳しい説明は以下をチェック!
②接触法
接触法は、
SO2をV2O5触媒に「接触」させることでSO3を作り、
濃硫酸を作る方法。
このV2O5触媒が発見されたこと自体が、
接触法のキモです。
③オストワルト法
オストワルト法は、
アンモニアを酸化させて硝酸を作る方法。
アンモニアを酸素と反応させると以下のようになります。
N2+O2⇄2NO
そして高温・白金触媒の条件を使うことで、
平衡反応が右に傾き、以下のようになります。
NOは低温で自然にNO2になり、
これを水に溶かします。
亜硝酸は分解されやすく、
となるため、結果的には、
となります。
より詳しい説明は以下をチェック!
④ハーバーボッシュ法
ハーバーボッシュ法は、
通常は低温でゆっくりしか進まないN2+3H3⇄2NH3の正反応を、
Fe3O4触媒を発明することで大量生産に成功した方法です。
そんなハーバーとボッシュの歴史や、
未来のアンモニアの製法も以下で解説しています。
⑤アルミニウムの製法
イオン化傾向が高いアルミニウムは単体にするのが難しく、
溶かしたアルミナAl2O3を直接電気分解する、
「融解塩電解」を利用します。
⑥鉄の製法
単体の鉄を手にいれるためには、
酸化鉄を一酸化炭素で還元します。
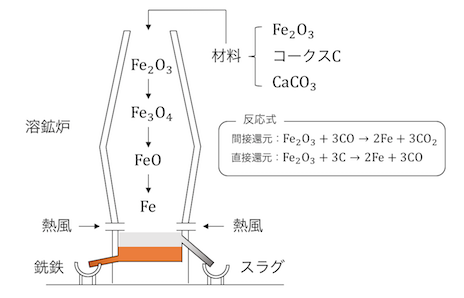
この際、不純物を取り除くために、
炭酸カルシウムを利用するんです。
鉄の製法は名前をたくさん覚える必要があるので、
ぜひ以下をチェックしてください。
⑦銅の製法
単体の銅は、
不純物の多い粗銅を「電解精錬」することで作ります。
電解精錬はただの電気分解なので、
電気分解さえ理解しておけば大丈夫でしょう。
以下の記事では、そもそも粗銅はどう作られるのか、
という内容から実際の計算問題の解説までしているので、
ぜひチェックしてください。
まとめ
工業的製法は確かに複雑ですが、
ひとつひとつの工程に理由があります。
それらをただただ丸暗記していては大変です。
「納得感」を持ちながら学んでいきましょう。














コメントを書く