ハロゲン化水素は強酸、HFのみ例外で弱酸。
ハロゲン化銀は水に難溶、AgFのみ例外で可溶。
などなど、
ハロゲンに関する知識は意外と細かいですよね。
さらにこれらの知識の理由を聞く、
記述問題も多く出題されるため、
苦手意識を持っている受験生も多いでしょう。
ハロゲンの性質がややこしく感じるのは、
ハロゲンの性質を仕組みから理解しておらず、
網羅的に学ぶことができていないからです。
ここではハロゲンの性質をまとめていきますね。
この記事を最後まで読むことで、
ハロゲンの本質的な知識が網羅的に理解でき、
即テストの得点につながることでしょう。
ぜひ最後まで読み飛ばさずに読んでみてください。
目次
ハロゲンとは?
「ハロゲン」とは周期表の17族元素のことで、
代表的なものとしてフッ素F、塩素Cl、臭素Br、ヨウ素Iがあります。
高校レベルでは、
主にこの4つが問われます。
ハロゲンは価電子を7個持つため、
1価の陰イオンになりやすいです。
つまり、
周りから電子を奪う酸化剤になりやすいということですね。
\mathrm{ 例)Cl_{2} + 2e^{-} → 2Cl^{-} }\]
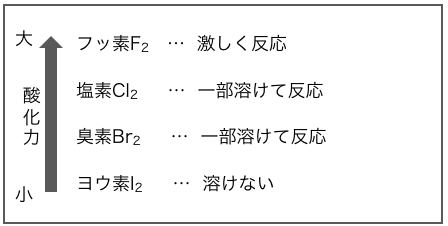
ハロゲンは酸化力が強いので、
さまざまな化学反応を起こします。
今回はその性質を確認していきましょう。
ハロゲン単体の性質
①色・状態
まずはハロゲンの色と状態から見ていきます。
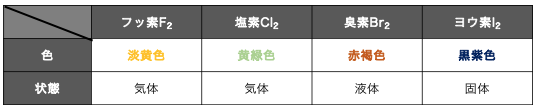
ハロゲンは、
分子量が大きいほど分子間力が強くなり、
気→液→固となっていきます。
具体的には、
F2(気) < Cl2(気) < Br2(液) < I2(固)
です。
色に関しては覚えるしかないので、
上の表をよく復習しておきましょう。
②ハロゲン単体の反応性
最初に説明した通り、
ハロゲンは酸化力が強いです。
これは、
周期表の右上ほど電気陰性度が高い、
ということからもわかりますね。
電気陰性度=電子を引っ張る強さ、
が大きいハロゲンは、
電子を奪う酸化剤になりやすいのです。
また、右上ほど電気陰性度が高いということは、
酸化力はF>Cl>Br>Iとなります。
これに注目してハロゲンの起こす反応を見ていきます。
ハロゲン同士の反応
酸化力がF>Cl>Br>Iということは、
フッ素Fほど反応してF–になりやすいということです。
つまりハロゲンのイオン化傾向は、
F>Cl>Br>Iとなっています。
これにより以下の反応が起きます。
\mathrm{ 例)Cl_{2} + 2Br^{-} → Br_{2} + 2Cl^{-} }\]
よりイオン化傾向が高いハロゲンが、
陰イオンになりたがる反応です。
\[ \mathrm{ Cu^{2+} + Zn → Cu + Zn^{2+} } \]
水素H2との反応
ハロゲンは原則水素H2と反応しますが、
酸化力の強さによって反応の激しさが変わります。

特にヨウ化水素HIは一部しか反応せず、
化学平衡のところでも出てきますね。
\mathrm{ H_{2} + I_{2} ⇄ 2HI }\]
水H2Oとの反応
ハロゲンと水との反応も、
水素同様、酸化力によって差が出てきます。
フッ素F2は電気陰性度が全元素中最強なので、
水からHを奪ってO2を発生させるという、
意味不明な反応を起こします。
\mathrm{ 2F_{2} + 2H_{2}O → 4HF + O_{2} }\]
塩素Cl2と臭素Br2は、
一部が水と反応して以下の平衡状態になります。
\mathrm{ Cl_{2} + H_{2}O ⇄ HCl + HClO }\]
そしてヨウ素I2は水とは反応できず、
水に溶けることができないため、
有機溶媒に溶けることができます。
ただし、ヨウ化カリウム水溶液には、
以下の反応によって溶けることができます。
\mathrm{ I^{-} + I_{2} → I_{3}^{-} }\]
ハロゲン単体の反応まとめ
水素との反応と水との反応をまとめると、
以下のようになります。
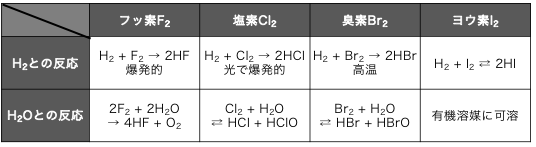
③ハロゲン単体の製法
工業的製法
塩素Cl2は、
NaOHの工業的製法である陽イオン交換膜法で、
陽極から得ることができます。
陽極:\( \mathrm{ 2Cl^{-} → Cl_{2} + 2e^{-} } \)
陰極:\( \mathrm{ 2H_{2}O + 2e^{-} → H_{2} + 2OH^{-} } \)
陽イオン交換膜法については
以下で詳しく解説しています。
【合わせてチェック】
・水酸化ナトリウムの製法、イオン交換膜法!
塩素より酸化力が弱いハロゲンについては、
ハロゲン化カリウムに塩素を吹き込んで作られます。
\mathrm{ 2KBr + Cl_{2} → Br_{2} + 2KCl }\]
しかしフッ素だけはイオン化傾向が高すぎて、
普通の方法では作ることができません。
入試レベルでは覚える必要はありませんが、
フッ化水素カリウムKHF2の融解塩電解によって、
フッ素F2が得られます。
陰極:\( \mathrm{ 2H^{+} + 2e^{-} → H_{2} } \)
実験室的製法
塩素Cl2の単体は、
濃塩酸HClを酸化させるか、
さらし粉からの弱酸遊離で得られます。
\mathrm{ MnO_{2} + 4HCl → MnCl_{2} + 2H_{2}O + Cl_{2} } \\
\mathrm{ CaCl(ClO)・H_{2}O + 2HCl → CaCl_{2} + 2H_{2}O + Cl_{2} }
\end{align*}
詳しい反応の原理は、
以下で解説しています。
ハロゲン化水素の性質
次にハロゲン化水素の性質を見ていきましょう。
塩化水素HClに代表されるように、
ハロゲン化水素は非常に重要な化合物です。
その性質を原理から抑えていきましょう。
①酸の強さ・沸点
ハロゲンはF→Cl→Br→Iの順で、
原子半径が大きくなっていきます。
原子半径が大きいほどHを離しやすいので、
HF < HCl < HBr < HIの順で酸性が強くなります。
特にフッ化水素HFだけが弱酸であることに、
注意しておきましょう。
また電気陰性度最強のFが作るフッ化水素は、
非常に極性が強いために以下のような水素結合をつくります。
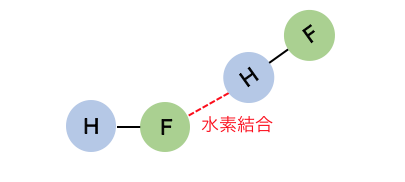
よってハロゲン化水素の沸点は、
普通は分子量の大きいHIほど高いはずですが、
HFは特別沸点が高くなります。
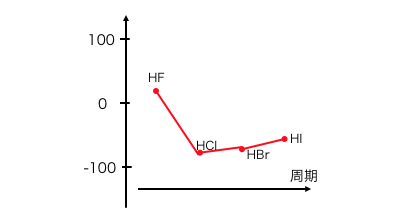
このように、
フッ化水素HFはいろいろ特殊な性質があるのですね。
②ハロゲン化水素の製法
工業的製法
ハロゲン単体の反応で説明した通り、
ハロゲン単体は水素と反応できるため、
以下の反応で得られます。
\mathrm{ H_{2} + X_{2} → 2HX }\) (Xはハロゲン)
実験室的製法
塩化水素HCl、フッ化水素HFは、
揮発性の酸遊離反応によって得られます。
\mathrm{ NaCl + 濃H_{2}SO_{4} → NaHSO_{4} + HCl (加熱)} \\
\mathrm{ CaF_{2} + 濃H_{2}SO_{4} → CaSO_{4} + 2HF (加熱)} \\
\end{align*}
詳しい解説は以下をごらんください。
③銀イオンとの反応
ハロゲンはイオン化傾向が高いため、
多くの場合、ハロゲン化物は水に溶けます。
ただし、銀Agは特別電気陰性度が高いため、
ハロゲン化銀は水に難溶です。
\mathrm{ Ag^{+} + X^{-} → AgX↓ }\]
ただし、
フッ素Fはやたらと電気陰性度が高いため、
AgFのみは水に溶けることができます。
フッ素Fはいつも変な性質を示しますね。
まとめ
今回はハロゲンの性質のまとめでした。
ハロゲンは反応性が高い分、
いろいろな性質が見られました。
特にフッ素Fが絡む例外が多いので、
きちんと確認をしておきましょう。













コメントを書く