今回はオストワルト法を解説します。
オストワルト法はアンモニアを酸化して、
硝酸を手にいれるための工業的製法です。
オストワルト法で出てくる反応式は非常に複雑で、
あなたも丸暗記に苦労しているのではないでしょうか。
そんなオストワルト法であっても、
もちろん反応には仕組みがあるのです。
この記事では「何が起こっているか」に注目しながら反応を説明します。
今までオストワルト法に関してモヤモヤしていた部分も、
この記事を読むことでスッキリ理解できるでしょう。
ぜひ最後まで読んでくださいね。
オストワルト法とは
「オストワルト法」とは、
白金触媒でアンモニアを酸化させることで一酸化窒素を作り、
それを原料に硝酸を作る手法です。
その反応は以下のように進みます。
②2NO+O2→2NO2
③3NO2+H2O→2HNO3+NO
この中でも一番大事なのが①の式です。
①の式は「白金触媒・800℃」という条件でNOができますが、
少し条件を変えるとN2ができます。
このように目的のものを手にいれるために、
無理やり高温にしたり触媒を使ったりしているため、
反応が想像しづらいのです。
これこそがオストワルト法を難しく感じさせている理由です。
それではこの3つの反応に分けて解説していきます。
オストワルト法の流れ
オストワルト法の流れは、
①白金触媒・800℃でNH3を酸化してNOへ
②NOに酸素O2を反応させてNO2へ
③NO2を水に溶かして硝酸を得る
です。
反応式は、
②2NO+O2→2NO2
③3NO2+H2O→2HNO3+NO
でしたね。
順番に解説します。
①NH3→NO(白金触媒・800℃)
まずはアンモニアNH3を酸化します。
アンモニアに酸素を触れさせると以下の反応が発生します。
N2+O2⇄2NO
2つ目の平衡反応では、
エネルギー的にはNOの方が不安定だから、
右向きの反応は吸熱反応です。
だから低温の場合はなかなかNOができません。
高温の状態で、さらに白金触媒を使うことで、
2つ目の平衡を右に傾けてNOを作ります。
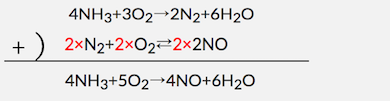
このように、「白金触媒・800℃」で平衡を操作することで、
うまくNOを作るのがオストワルト法のキモになります。
平衡状態とは「エネルギーが低くなる力」と「バラバラになる力」から生じます。NOの方がNとOが均一になっていてバラバラになっていますね。化学平衡の詳しい説明は以下をチェック!
絶対にわかる化学平衡の仕組み
②NO→NO2
①で作ったNOは、
低温では酸素に簡単に酸化されてしまいます。
この反応は問題ないでしょう。
2CO+O2→2CO2
③NO2→HNO3
最後に二酸化窒素NO2を温水に溶かして硝酸を作ります。
しかしこの亜硝酸HNO2は不安定なので、
以下の反応によってすぐに分解されてしまいます。
これによって結果的に以下の反応になります。
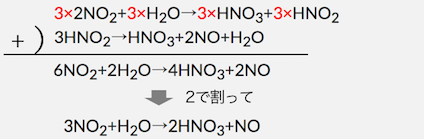
2NO2+H2O→HNO3+HNO2
は、なんとなく塩素が水に溶ける反応に似ていますね。
Cl2+H2O⇄HClO+HCl
反応の全体像
②2NO+O2→2NO2
③3NO2+H2O→2HNO3+NO
の3段階によって反応によって硝酸ができました。
この反応式を1つにまとめると以下です。
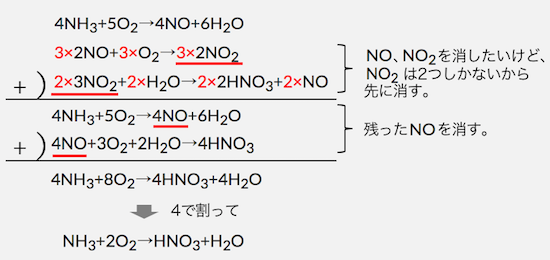
まとめてしまえば、
一酸化窒素や二酸化窒素を経由しながら、
アンモニアを酸化させて硝酸を得る方法、
ということになりますね。
まとめ
今回は「オストワルト法」の解説をしました。
オストワルト法は、
①4NH3+5O2→4NO+6H2O(Pt触媒、800℃)
②2NO+O2→2NO2
③3NO2+H2O→2HNO3+NO
の3段階。
白金触媒・800℃でうまいことNOを作るのがキモでした。
このように「化学反応のストーリー」を理解すると、
なぜか暗記が楽に感じてきますね。
オストワルト法の反応式の係数は複雑なので、
今一度自分で式を立ててみて、
無理そうならもう一度復習してみるなどするといいです。














コメントを書く