沈殿を作るの物質はなにか。
錯イオンになって溶けるのはなにか。
沈殿の色はなにか。
このように、金属の系統分析は、
暗記量も多くて大変な分野です。
いつまでたっても知識が定着しないのは、
系統分析の流れを知らないからです。
系統分析はその場その場で薬品を入れているわけではなく、
基本的なルールがあります。
系統分析のルールを理解しておくことで、
沈殿が発生する薬品との関係がきれいに整理されて、
より秩序のある暗記になるでしょう。
ただ闇雲に覚えるだけでは入試本番に不安になってきます。
この記事を読むことで、
陽イオンの系統分析は満点を取れるようになりましょう。
目次
陽イオンの系統分析とは
陽イオンの系統分析とは、
水溶液中にどんな金属イオンが潜んでいるか、
を分析することを言います。
産業革命が進んだ時代、
日本では「水俣病」や「イタイイタイ病」などの、
いわゆる四大公害病が流行しました。
これらの原因となったのが、
水銀HgやカドミウムCdなどの重金属を含むイオンです。
このように、
水溶液中の金属イオンを識別することは、
実用上かなり大事な作業ということです。
だから系統分析は古くから科学者が取り組んだ分野で、
系統分析の手順はその過程でルール化されていったのです。
偉大な科学者が長年かけて作ったルールを使わないわけにはいきません。
系統分析をその手順から理解していきましょう。
系統分析の方法

以上のように系統分析は、
①HClを入れる
②酸性でH2Sを入れる
③煮沸+硝酸→NH3を入れる
④塩基性でH2Sを入れる
⑤(NH4)2CO3を入れる
⑥炎色反応を見る
の6段階で行います。
それぞれの段階を確認しましょう。
①HClを入れる
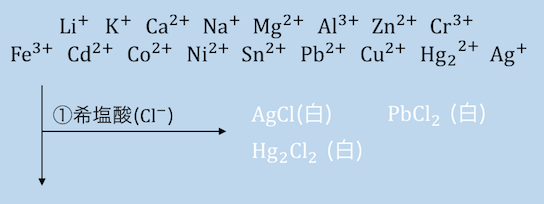
まずは塩酸HClを入れることで、
Pb2+、Ag+、Hg22+を沈殿させます。
このうちPbCl2は熱水に溶け、
AgClは過剰のNH3で[Ag(NH3)2]+となって溶けます。
最後まで溶けなかったものがHg2Cl2です。
沈殿を取り除いて②以降の操作へ進みます。
Hg22+は水銀原子2つが繋がってできたイオンです。Hg2Cl2はCl-Hg-Hg-Clという構造になっています。
②酸性でH2Sを入れる
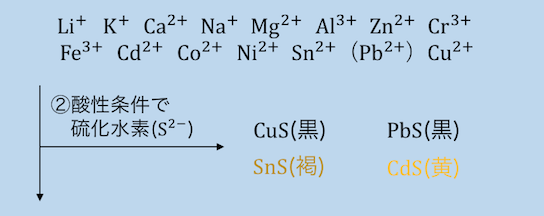
さきほどのHCl酸性の状態で硫化水素H2Sを入れます。
酸性状態では、
の平衡が左に進むのでS2-の量が減ります。めちゃくちゃ少ないS2-でも沈殿しちゃうようなやつをここで沈殿させているのです。
ここで沈殿するのはCd2+、Sn2+、Pb2+、Cu2+です。
イオン化傾向がSn以下のものとCdが沈殿しています。
③煮沸+硝酸→NH3を入れる

次にアンモニアNH3を入れて水酸化物沈殿を作ります。
しかしその前に、
Feイオンが硫化水素H2Sに還元されてFe2+になっているので、
煮沸してH2Sを飛ばし、酸化剤である硝酸を入れてFe3+に戻します。
そしてNH3を加えることで、Al3+、Fe3+、Cr3+が沈殿します。
Al(OH)3は白色沈殿、
Fe(OH)3は赤褐色沈殿、
Cr(OH)3は灰緑色沈殿です。
④塩基性でH2Sを入れる
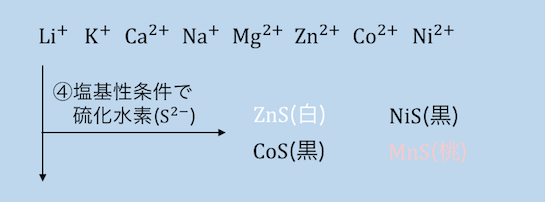
NH3の塩基性状態で再度硫化水素H2Sを入れます。
これによってイオン化傾向Al以上の金属はすべて沈殿します。
つまりH2Sによって、Mn2+、Zn2+、Co2+、Ni2+が沈殿します。
MnSは桃色沈殿、
ZnSは白色沈殿、
CoSとNiSは黒色沈殿です。
⑤(NH4)2CO3を入れる
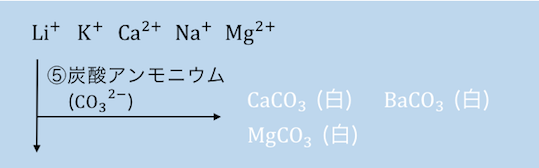
残っているのは1族、2族の金属のみです。
(NH4)2CO3を入れることで、2族元素であるCa2+、Ba2+、Mg2+が沈殿します。
⑥炎色反応を見る
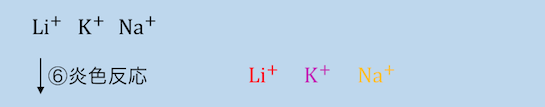
最後に残った金属はイオン化傾向の高いアルカリ金属のみで沈殿は作れません。
だから最後は「炎色反応」で識別します。
Li+は赤、K+は赤紫、Na+は黄色です。
まとめ
金属陽イオンの系統分析の手順は以下のようになるのでした。

当然すぐに覚えきれるものではないので、
繰り返しこのページを見るようにするといいでしょう。
ここにあげた沈殿や色を一度覚えておくと、
ここにあるもの以外を例外として覚えることができ、
より覚えやすいです。
関連で以下も参考にしておいてください。














コメントを書く