アンモニアソーダ法(ソルベー法)は高校化学で習う、
炭酸ナトリウムの工業的製法です。
アンモニアソーダ法は反応する物質が多く、
反応式の意味もわかりづらいので暗記に苦労しますよね。
必死に語呂合わせなどで丸暗記しようとする人も多いでしょう。
しかし「なぜこの製法が考案されたか」に注目すれば、
アンモニアソーダ法はまったく難しくないのです。
この記事を読んで反応式の意味を本質的に理解し、
さらに工業的製法として利用される理由を理解すれば、
全く苦労せずに反応を覚えられるでしょう。
今までの理解度との違いに驚くと思います。
本質的理解なしの丸暗記は時間が経てば忘れてしまいます。
この記事できっちりと理解していきましょう。
目次
アンモニアソーダ法とは
「アンモニアソーダ法」とはその名の通り、
アンモニアNH3の力を借りて、炭酸ナトリウムNa2CO3(炭酸ソーダ)を作るための工業的製法です。
その基本的な考え方は、
という沈殿生成反応を起こし、
この炭酸水素ナトリウムに対して、
の熱分解反応を起こすことで炭酸ナトリウムを作るという単純なものです。
しかし「工業的製法」というからには、
安く大量生産できる必要がありますね。
そこで重要な役割を担うのが「アンモニアNH3」と「炭酸カルシウムCaCO3」です。
この2つを利用することがアンモニアソーダ法のキモであり、
それが反応式を少しややこしく見せています。
まずは反応式の理論的・本質的な部分を理解し、
次に全体の流れを追っていきます。
【永久保存版】無機化学の反応はたった6つ!
アンモニアソーダ法の反応式
先ほど説明した通り、
の反応を起こすことがこの製法の目的です。
Na+の溶けた水溶液にCO2を入れれば良さそうですが、
実際はCO2の溶解度が小さくなかなか反応が進みません。
そこでアンモニアを加えて中和反応を起こすことで、
CO2を溶かします。
これと先ほどの目的の式を合わせれば、
Na+を手にいれるのに一番安価に済みそうな「食塩NaCl」を用いれば、
最後に熱分解をすれば炭酸ナトリウムの完成です。
このように、
NH3を利用することで反応を効率良く進めるのが、
アンモニアソーダ法のキモになる部分です。
確かに反応しますが、CO32-は弱酸なのでHCO3–と平衡状態になります。ここでNaHCO3の溶解度積がかなり小さいので沈殿生成反応が起こり、平衡がHCO3–生成側に傾き、…を繰り返して反応が進みます。
アンモニアソーダ法の仕組み
反応が起こる仕組みは理解できましたね。
しかし実際に工業的に大量生産するためには、
できるだけ効率的に反応を起こしたいです。
そこで大事な役割を担うのが「炭酸カルシウムCaCO3」。
炭酸カルシウムを利用することで、
反応の「ゴミ」をうまく再利用することができるのです。
炭酸カルシウムも非常に安価に手に入るので、
材料としてはぴったりです。
炭酸カルシウムの働きに注目して見ていきましょう。
アンモニアソーダ法は、
①CaCO3を熱分解する
②生じたCaOを水に溶かしてCa(OH)2にする
③沈殿生成により炭酸水素ナトリウムを作る
④熱分解により炭酸ナトリウムを作る
⑤NH4ClにCa(OH)2を入れてNH3を遊離させる
の流れになっています。
①CaCO3を熱分解する
まずはCaCO3を焼きます。
このCO2が炭酸水素ナトリウムの材料になります。
②生じたCaOを水に溶かしてCa(OH)2にする
CaOは水に混ぜるだけで容易にCa(OH)2になります。
このCa(OH)2が後で役立ってきます。
③沈殿生成により炭酸水素ナトリウムを作る
先ほど①で作ったCO2を食塩水に入れ、
さらにNH3をいれることで炭酸水素ナトリウムNaHCO3を作ります。
ここでNH4Clという「ゴミ」が出てしまっていることを覚えておきましょう。
④熱分解により炭酸ナトリウムを作る
炭酸水素ナトリウムを加熱して炭酸ナトリウムを作ります。
ここで発生したCO2は、
炭酸水素ナトリウムの材料に再利用できそうです。
⑤NH4ClにCa(OH)2を入れてNH3を遊離させる
最後にゴミ処理です。
「弱塩基遊離反応」によってNH3を取り出します。
このNH3は炭酸水素ナトリウムの材料に再利用します。
反応の流れまとめ
以上をまとめるとこうなります。
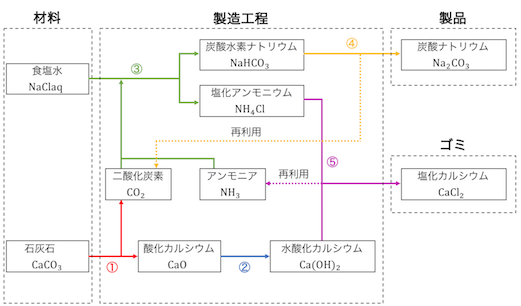
④の熱分解で生じるCO2、
⑤の弱塩基遊離で生じるNH3を再利用することで、
最終的な「ゴミ」はCaCl2のみになりました。
「材料・製品・ゴミ」だけに注目すれば、
という無駄のない反応であるとわかります。
このようにアンモニアソーダ法は、
安価な材料を利用し、「ゴミ」を再利用することで、
効率良く炭酸ナトリウムを手にいれることができます。
反応の流れ自体は複雑に見えますが、
「おもわく」を理解すると難しくないですね。
アンモニアソーダ法の現在

入試には問われませんが、
少しだけ歴史的な話もしておきましょう。
その昔は炭酸ナトリウムを作るのに「ルブラン法」という製法を用いました。
しかしルブラン法は、
とにかくたくさんゴミが出る
という問題があったのです。
ゴミから生じた「硫化水素」の被害で、
工場が訴訟を受けるほどでした。
そんな中、
1861年にベルギーの化学者エルネスト・ソルベーが
考え出したのが「ソルベー法(アンモニアソーダ法)」。
これによってルブラン法は廃れていき、
ソルベー法が炭酸ナトリウムの製法の主流になっていったのです。
しかしそんなソルベー法にも退廃の時期はやってきます。
1938年、アメリカ合衆国で「トロナ」という鉱物の、
巨大な鉱床が発見されます。
(トロナはNa2CO3、NaHCO3などが混ざった水和物)
これによってソルベー法は衰退、
1986年、最後の工場が閉鎖しました。
まとめ
今回はアンモニアソーダ法(ソルベー法)の解説でした。
アンモニアソーダ法の第一のアイデアは、
Na++HCO3–→NaHCO3↓
のようにアンモニアを利用して沈殿生成を進めること、
第二のアイデアはCaCO3を利用して、

という効率的な仕組みを作ることでした。
ここまで理解すればもう
丸暗記とは違った感覚ではないでしょうか?
これでもうセンター試験・二次試験で問われても
自信を持って回答できるでしょう。














コメントを書く