「アルデヒドは還元性があって…」
「銀鏡反応?フェーリング反応?ってなんだっけ?」
「ヨードホルム反応はいつ起こるんだっけ…?」
あなたもこのように困ってしまうことはありませんか?
アルデヒドやケトンではいろんな反応があるため、
完璧に覚えきるのはなかなか難しいものです。
これらの反応が覚えられないのは、
カルボニル化合物の反応性の高さの理由を、
本質的に理解していないからです。
ヨードホルム反応がどうとかいう前に、
アルデヒドやケトンが何者なのかを知らなければ覚えられるはずがないのです。
ここではアルデヒドとケトンについて解説していきますね。
ここの内容を理解することで、
すべての反応を納得感を持って理解することができ、
構造決定などで現れても一瞬で解答できるようになります。
「なんで学校の先生は教えてくれなかったの?」
という気持ちになるでしょう。
ただし前提知識などが抜け落ちていると、
わかるものもわからなくなってしまいます。
できるだけ読み飛ばさずに最後まで読んでみてください。
アルデヒド・ケトンとは
以下のような構造を持つ化合物を、
「カルボニル化合物」といいます。
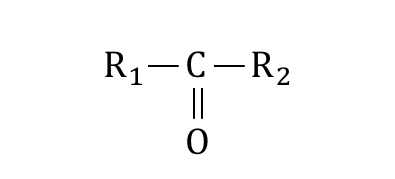
カルボニル化合物のうち、
R2が水素原子であるようなものを「アルデヒド」、
R2が炭化水素であるようなものを「ケトン」と呼びます。
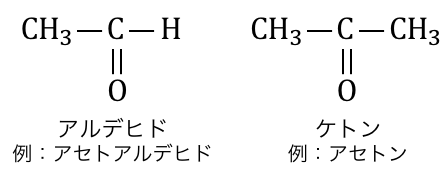
酸素原子Oは電気陰性度が非常に高く、
さらにC=Oというように二重結合になっているため、
カルボニル化合物は一般には反応性が高いです。
しかしアルコールのときと同様、
近くに水素原子を持つアルデヒドとそうでないケトンで反応が変わってきます。
アルコールをきっちり理解したあなたなら、
「きっと水素を持つアルデヒドの方が反応性高いよな」
と思うはずです。
それではカルボニル化合物の反応性を、
仕組みに注目しながら確認していきましょう。
二重結合はp軌道を利用したπ結合が存在しています。π結合は分子の外に向き出し状態になっているので、周りの分子と干渉しやすいのです。「p軌道?π結合?」という人は以下を読んでみてください。
合わせてチェック:
軌道の形を理解するだけで、有機化学をが得意科目に!?
アルデヒドの反応
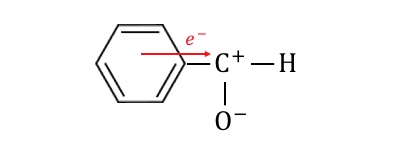
酸素は電気陰性度が非常に大きいので、
カルボニル化合物のC=Oは酸素が電子を引っ張りまくっています。
極端に言えば、
以下のようにイオン化を起こしているような状態です。

二重結合のうちの片方が共有結合のまま、
もう片方がイオン結合になっているイメージです。
そんな状態の炭素に何かがぶつかり、
水素を追い出すことで還元反応を起こすことができるのです。
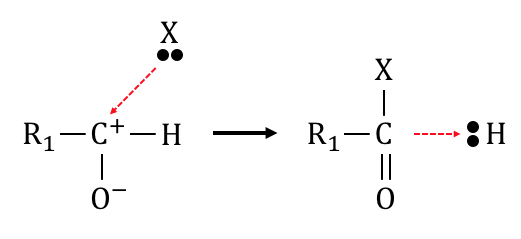
これがアルデヒドの反応の基本原理です。
水素Hよりも結合を求めている元素Xが来た時に、
炭素が陽性になっていることで反応がスタートできるのです。
ちなみに構造を見れば水に溶けることもすぐにわかりますね。
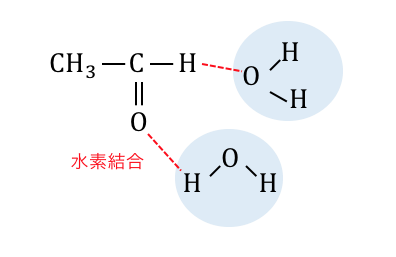
アルデヒドの強い還元性を利用した検出反応に、
「銀鏡反応」と「フェーリング反応」があります。
順番に確認していきましょう。
銀鏡反応

(銀鏡反応の写真)
アルデヒドの還元性を利用して、
銀イオンを還元することで銀を遊離させる反応が、
以下の半反応式で表される「銀鏡反応」です。
Ag++e–→Ag↓
合わせてチェック:
酸化還元反応の仕組みを酸化数から理解しよう!
しかし、
イオン化傾向が低いとは言え金属である銀は、
そう簡単には還元されません。
そこでアンモニアを入れて、
発生するカルボン酸を中和して減らすことで、
「ルシャトリエの原理」を利用して反応を進みやすくします。
酸化還元反応の仕組みに化学平衡の仕組みを組み合わせて反応を進めるのです。
銀イオンの水溶液にアンモニアを溶かしておくと、
銀イオンは錯イオンを作りますね。
これを考慮すると以下のような反応になります。
[Ag(NH3)2]++e–→Ag↓+2NH3
よって銀鏡反応の反応式は以下のようになります。
→RCOONH4+2Ag+3NH3+H2O
反応式は複雑ですが、
やっていることは「金属を遊離させて検出する」というだけですね。
フェーリング液の還元
銀イオンを還元して遊離させる銀鏡反応に対し、
銅イオンを還元してCu+にし、Cu2Oの赤色沈殿を作るのが「フェーリング反応」です。
Cu2++e–→Cu+
フェーリング反応は実際はもう少し複雑なので、
入試レベルではこれ以上深く問われることはないでしょう。
ただしフェーリング反応には例外が2つあることに注意しましょう。
まず1つ目の例外は「ベンズアルデヒド」。
アルデヒドは以下のような状態になるのが、
還元性が強い理由でした。

しかしベンズアルデヒドでは、
アルデヒド基の隣に電子をたくさん蓄えたベンゼンがいるため、
炭素の陽性が和らげられます。
これによってベンズアルデヒドは、
フェーリング反応を起こしにくいです。
2つ目の例外は「ギ酸」。
ギ酸もアルデヒド基は持っていますが、
銅イオンと錯体を作ってしまうので反応しづらいです。
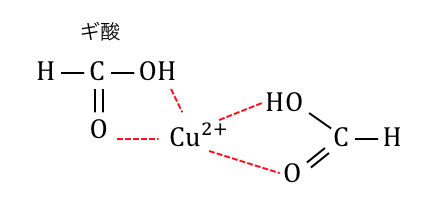
なかなかめんどくさい例外ですが、
仕組みから理解すれば忘れてもすぐに思い出せます。
きちんと仕組みから理解しておきましょう。
銅イオン、酒石酸イオン、水酸化ナトリウムなどを上手く混ぜた液を「フェーリング液」と呼びます。
ケトンの反応
次にケトンの反応を見ていきましょう。
アルデヒドと同様、
ケトンもC=Oの炭素が反応しやすくなります。
しかしアルデヒドと違って水素がいないため、
還元反応を起こすことはできません。
しょうがなくR1とR2と陽性の炭素で、
助け合いながらバランスを保つのです。
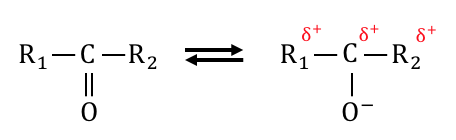
このように水素がないことで反応が進まないため、
よっぽど上手く反応させないと反応しません。
そしてよっぽど上手く反応させたのが「ヨードホルム反応」です。
少し難しいですが頑張って反応を追いかけてみましょう。
ヨードホルム反応
「ヨードホルム反応」とは、
以下の構造を持つケトンやアルコールにNaOHとI2を加えると、
ヨードホルムCHI3の黄色沈殿が生じる反応です。

まず前提として、
「なんでこの2種類の構造で反応するの?」
というところを解決しておきます。
ヨウ素I2はハロゲンなので電子を欲しがっています。
上の②の構造のアルコールは、
第二級アルコールなので電子を投げて酸化されますね。
結局のところヨードホルム反応は①の構造で起こるということです。
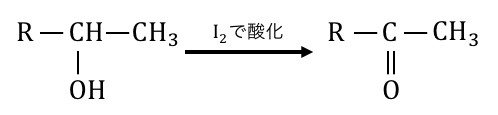
では次に、
「なぜ①の構造で反応するの?」
というところを見ていきましょう。
先ほど説明した通り、
C=Oの構造があるせいで炭素たちは少し陽性になっています。
これによって右端の水素たちが、
少し外れやすい状態になっています。
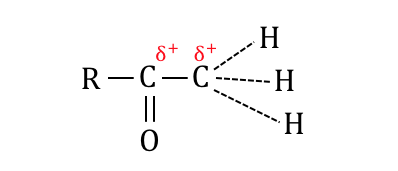
そこを狙ってヨウ素たちが攻撃を仕掛けます。
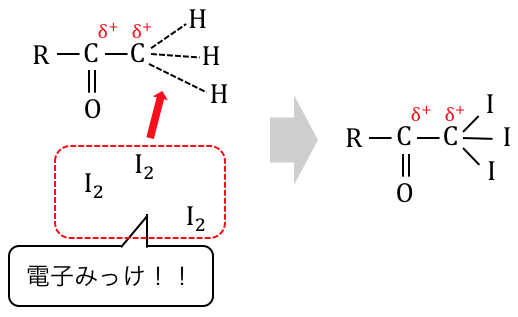
ただでさえ陽性になっていた炭素たちに、
ハロゲンであるヨウ素が大量にくっついてしまいました。
これでは炭素の陽性が悪化してしまいます。
その隙をついて、
水酸化物イオンが炭素に攻撃を仕掛けるのです。
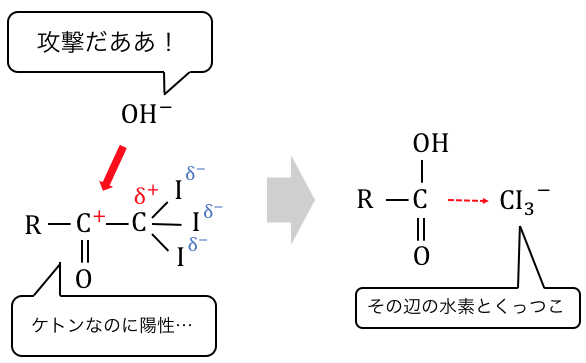
このようにハロゲンやら酸素やらの、
電気陰性度の強いやつらにフルボッコにされるのがヨードホルム反応なのです。
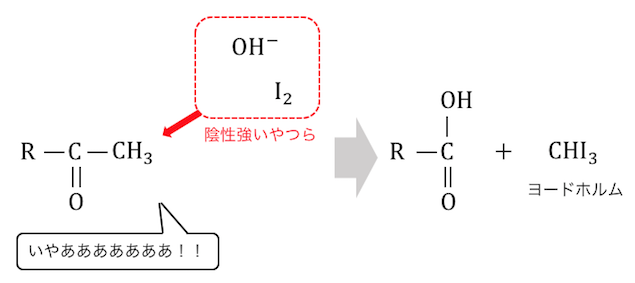
ちなみにもしこんな構造のケトンがあったらどうでしょうか。
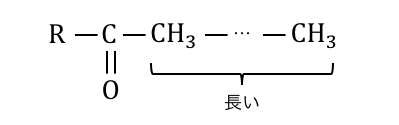
この場合は一番右端の炭素はC=Oから遠く、
そこまで陽性にはなりません。
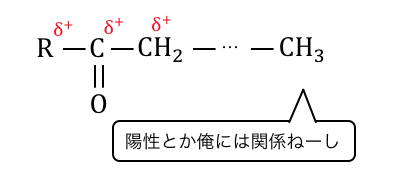
結局のところC=Oのすぐ隣に-CH3がいるときに限って、
ヨードホルム反応が起こるということです。
まとめ
今回はアルデヒドとケトンの解説でした。
カルボニル化合物は二重結合の酸素がいるせいで、
以下のようになってしまうのでした。

これのせいで、
アルデヒドは水素が引き抜かれて酸化されてしまい、
ケトンは-CH3が陽性になってヨードホルム反応が起こるのでした。
これまでアルカン・アルケン・アルキン、
アルコール、カルボニル化合物と解説してきましたが、
そろそろ「なんで反応するのかな?」という思考回路になってきましたか?
「こういうものなんだ、覚えよう」
と多くの受験生が考えている中、
反応の仕組みから理解することで、
「こんな反応当然じゃーん!」
と思えるとものすごいアドバンテージです。
まだアルカンやアルコールの記事を読んでいないあなたは、
今すぐ読んでみてください。














コメントを書く