カルボン酸は入試頻出で、
特に酢酸などは理論化学から出てくるため、
そこまで苦手意識はないかもしれません。
しかし、
「なんで特別酸性が強いの?」
「なんで特別融点が高いの?」
などと聞かれると迷ってしまうのではないでしょうか。
これからもわかるように、
なんだかんだ有機化学的にしっかり理解できている人は少ないのです。
ここではカルボン酸の性質を仕組みから説明していきます。
ここの内容を理解することで、
センター試験頻出のような問題はもちろんのこと、
二次試験の説明問題も解けるようになります。
カルボン酸は出題頻度が高い分、
理解した時に得られるものも多いでしょう。
それでは解説していきます。
目次
カルボン酸とは
「カルボン酸」とは、カルボキシ基-COOHを持つような有機化合物です。
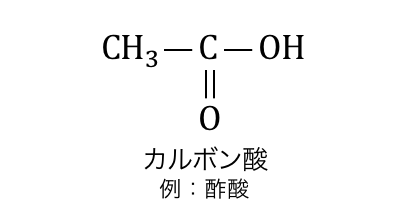
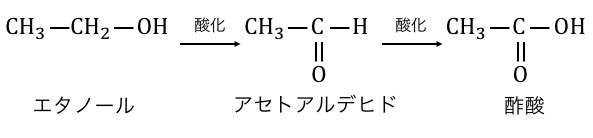
カルボン酸はアルコールの酸化によって手に入りましたね。
カルボン酸は有機物にしてはかなり強い酸性を示します。
これはカルボキシ基のC=Oの構造が、
反応性が高いからです。
この反応性の高さに関しては、
アルデヒド・ケトンの記事で説明したので、
この記事を読む前に参考にしてみてください。
カルボン酸の性質
カルボン酸には、
他には見られないような面白い性質があります。
それは、
・予想以上に酸性が強い
・予想以上に融点が高い
ということです。
たとえばアルコールだって-OHを持っていますが、
酸としては水よりも弱いです。
それなのにカルボン酸は酸性が強いのです。
なぜこのような面白い性質が見られるのか、
順番に考えていきましょう。
カルボン酸が酸性である理由
先ほども説明したように、
カルボン酸はそこそこ強い酸性を示します。
しかしアルコールは同じように-OHがあるのに、
電離定数はかなり低かったですね。
ROH⇄RO–+H+(電離定数10-15)
同じ構造を持ちながら何故ここまで性質が違うのでしょうか?
以前も説明したように、
カルボニル基C=Oは以下のようにイオン化のようなことが起こっています。
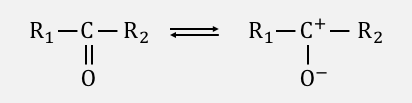
C=Oの酸素の電気陰性度が強いため、
結合の電子を奪ってしまうのでしたね。
炭素の陽性が高くなれば周りから電子を吸い取ろうとします。
その結果-OHの先についた水素が電離させられ、
炭素の陽性がカバーされるのです。
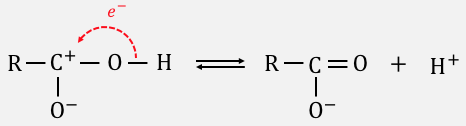
このように、
C=Oの酸素原子が電子を欲しがるせいで、
そのツケが水素原子に行ってしまった結果、
酸性になっているのですね。
カルボン酸の融点が高い理由
カルボン酸は同程度の分子量の有機物に比べ、
融点がかなり高いです。
カルボン酸の融点が高いのは、
カルボキシ基どうしで水素結合を作り、
「二量体」の形で存在する場合があるからです。
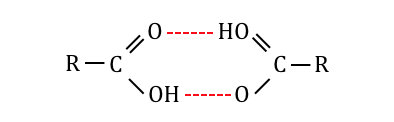
これによって実質の分子量が2倍になり、
分子間力が大きくなることで融点が高くなります。
カルボン酸の反応
カルボン酸は、
・酸としての反応
・脱水反応
・エステル化
などのいろんな反応を起こします。
その仕組みを順番に見ていきましょう。
酸としての反応
カルボン酸はある程度強い酸なので、
水溶液中で「中和反応」や「弱酸遊離反応」などを起こします。
CH3COOH+NaOH→CH3COONa+H2O
(弱酸遊離反応)
CH3COONa+HCl→NaCl+CH3COOH
NaHCO3+CH3COOH→CH3COONa+H2CO3
弱酸遊離反応の1つ目では、
弱酸である酢酸が強酸であるHClに遊離させられています。
一方、弱酸遊離反応の2つ目では、
電離定数10-7程度である炭酸が、
電離定数10-5程度である酢酸に遊離させられています。
あくまで弱酸遊離反応における酸の強さは相対的なものでしたね。
ちなみにこの反応では炭酸が遊離し、
それが分解して二酸化炭素が生じて気泡が生じるため、
酢酸の検出反応としても使われます。
脱水反応
カルボン酸を乾燥剤とともに熱することで、
脱水反応を起こすことができます。
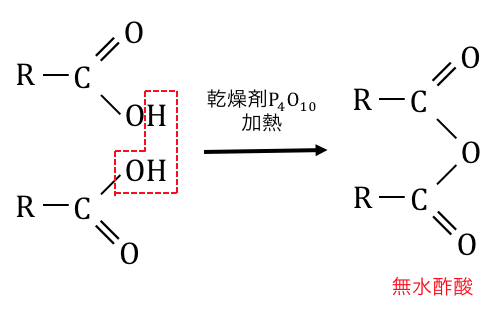
これは想像しやすい反応ですね。
ただしこの反応は起こりづらいため、
濃硫酸などでは反応を進めることができず、
より強力な乾燥剤であるP4O10を使う必要があります。
このように酢酸が分子間脱水したものを「無水酢酸」といい、
反応が起こりづらかったことからもわかるように、
非常に反応性が高いです。
エステル化
カルボン酸とアルコールを濃硫酸とともに加熱し、
脱水反応を起こしてくっつけたものを「エステル」と呼びます。
エステル化は高校の有機化学の中で、
最重要な反応といっても過言ではありません。
なぜなら構造決定の問題では、
必ずといっていいほどエステル化が関係してくるからです。
エステルに関する詳しい説明は以下で行うので、
そちらをチェックして見てください。
注意したいカルボン酸
カルボキシ基に直接水素だけがついた「ギ酸」には注意が必要です。
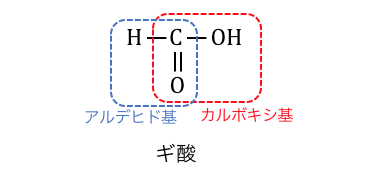
この構造式からわかるように、
ギ酸はカルボン酸でありながらアルデヒドの構造も持ちます。
よってギ酸は還元性も示すのです。
それによって「銀鏡反応」を起こします。
例外である分試験では問われやすいので、
きっちりと覚えておきましょう。
起こりづらいです。カルボン酸の構造のせいでフェーリング液中の銅イオンと錯体を作ってしまうからです。詳しくはアルデヒドの記事を読んでみてください。
合わせてチェック:
アルデヒド・ケトンの反応を解説!
まとめ
今回はカルボン酸の解説をしました。
カルボン酸はカルボニル基があることによって、
アルコールの何倍もの酸性を示すのでした。
また、二量体を作ることにも注意が必要ですね。
カルボン酸は有機化学の中でも相当出てくる頻度が高いので、
きっちりと物性を理解しておきましょう。














コメントを書く