フェノールの工業的製法「クメン法」は、
高校化学の中でもかなり複雑な反応です。
そのため暗記に苦労している人も多いでしょう。
クメン法がわからなくなってしまうのは、
反応の手順を理解していないからです。
ここではクメン法の手順を解説していきますね。
ここの内容を理解することで、
クメン法で出てくる物質の構造式もサラサラ書け、
テストでも苦労せず満点を取れるようになります。
「クメン法って複雑だけど面白い!」
と思えるようになるでしょう。
ぜひ最後まで読んでみてください。
クメン法とは
「クメン法」とは、以下のような複雑な仕組みで、
フェノールを作る工業的製法です。
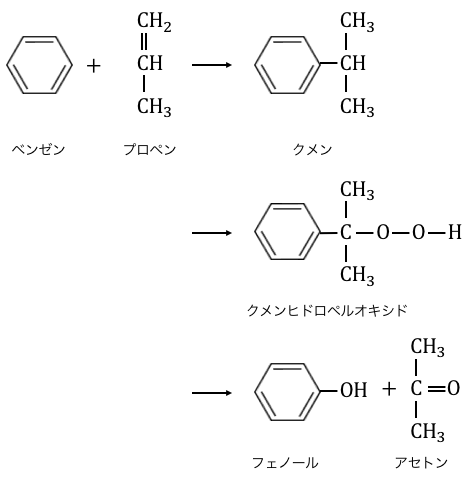
ベンゼンにヒドロキシ基-OHが付いただけの物質に、
どうしてこんなに複雑な仕組みが必要なのでしょうか?
これにはベンゼンの仕組みを思い出す必要があります。
ベンゼンは二重結合が3つもあることによって、
「電子の雲」をまとっているのでしたね。
そんなベンゼンに陰イオンのOH–が近づくことは、
当然できません。
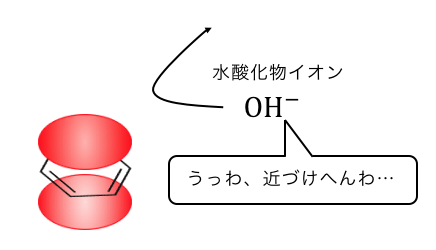
だからどうにか-OHをくっつけるために、
複雑な反応になってしまうのです。
クメン法が発案される前には、
・ベンゼンスルホン酸のアルカリ融解
・クロロベンゼンを利用する方法
などがありました。
しかし、
これらは高温高圧で頑張って反応させないといけません。
それに比べてクメン法は、
比較的楽に合成できるのに加えて、
副産物として「アセトン」が手に入る素晴らしい方法です。
一粒で二度美味しい方法なんですね。
それでは、
そんなクメン法の仕組みを確認していきましょう。
【合わせてチェック】
・ベンゼンの性質・反応を解説!
・フェノールの製法・性質・反応をどこよりも詳しく解説!
クメン法の仕組み
クメン法は、
①クメンを作る
②クメンを酸化する
③酸で分解してフェノールを得る
の順でフェノールを作ります。
正直クメン法はとっても複雑なので、
難しく感じるのは当然だと思います。
できるだけわかりやすく解説するので、
ぜひ最後まで見てみてください。
①クメンを作る
クメン法で用いる材料は、
「ベンゼン」と「プロペン」です。
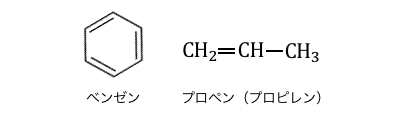
この2つをくっつけたいです。
ベンゼンには「電子の雲」がありますから、
ベンゼンの反応の基本は、
「陽イオンの攻撃」による置換反応でしたね。
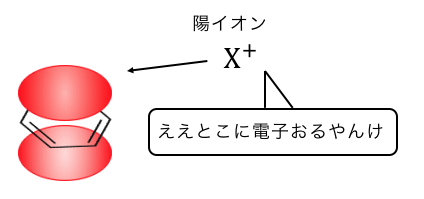
だからうまくプロペンを陽イオンみたいにしたいわけです。
そこでまずはプロペンに濃硫酸を入れて、
H+を押し付けてあげましょう。
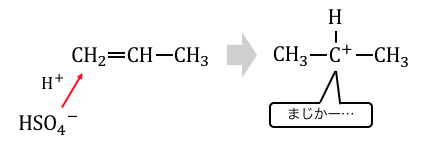
この状態は当然不安定ですから、
電子の雲を持ったベンゼンに攻撃を仕掛けます。
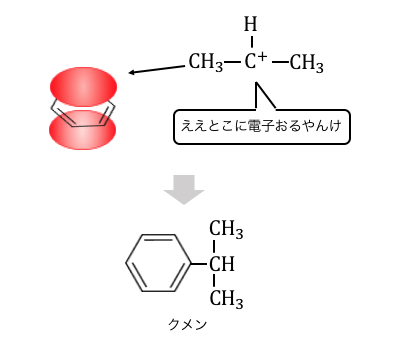
このようにしてクメンが作られるのです。
②クメンを酸化する
フェノールの-OHが電子不足で電離したのと同様、
プロピル基の真ん中の炭素は、
ベンゼンがくっつくことで少し電子不足です。
そんなクメンを温めると、
水素が外れてしまうのです。
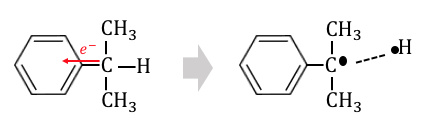
そこに酸素を吹き込むことで酸化反応が起こるのです。
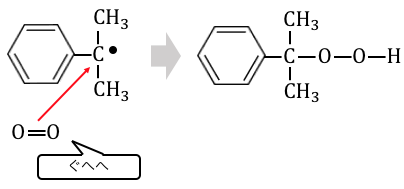
こうしてできるのが、
「クメンヒドロペルオキシド」です。
③酸で分解してフェノールを得る
最後に酸で分解してフェノールを手に入れます。
これはとっても複雑なので、
結果だけ覚えてしまっても問題無いです。
どうしても気になる人のために、
簡単に説明しますね。
「過酸化水素(ハイドロゲンペルオキシド)」は、
不安定な物質で、以下のような反応をしましたね。
これと同じように、
酸を入れると水が放出されてしまいます。
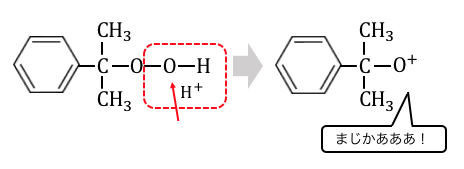
これによって酸素が陽イオンのようになってしまうのです。
酸素は電気陰性度がかなり強いですから、
かなり嫌な状態です。
ベンゼン環に付いた炭素の方が電気陰性度が低いため、
酸素は炭素と居場所を入れ替えるという強硬手段に出ます。
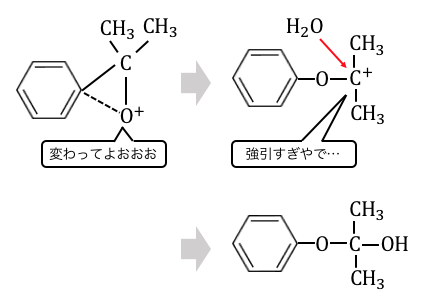
これによってなかなかベンゼンに近づけないO原子が
ベンゼンにくっつきました。
最後にアセトンが剥がれてフェノールの完成です。
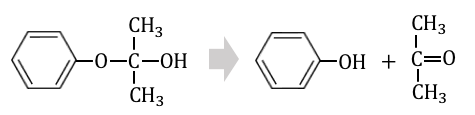
とってもとっても複雑な反応でしたね。
あえて覚える意味もないですが、
「フェノールって大変なんだなー」
と思っておけば十分だと思います。
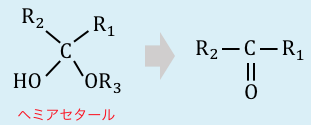
最後の構造は「ヘミアセタール」という不安定なもので、一般に以下のように反応してしまいます。
クメン法まとめ
復習しておくとクメン法は、
①クメンを作る
②クメンを酸化する
③酸で分解してフェノールを得る
の順でフェノールを作るのでした。

難しい反応がたくさんあるので、
なんども復習しておきましょう。
参考:ベンゼンの直接酸化
「フェノールを作るのって大変だな…」
と思いますよね。
もしも以下のように簡単にできたら嬉しいですよね。
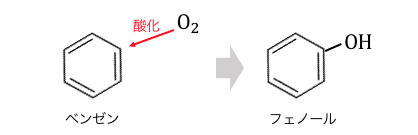
もちろんそういう研究は進められていますが、
最初に言った理由のせいで相当難しく、
「10の最も困難な化学反応」とさえ呼ばれています。
しかし近年東京大学の岩澤教授らによって、
この化学反応を効率よく進める触媒が開発されました。
その触媒はレニウムという金属を利用したもので、
アンモニアの存在下で空気とベンゼンを触れさせると、
なんと94%の効率でフェノールを得ることができます。
残りの6%も二酸化炭素だけで環境にも良いです。
将来の化学の教科書では、
クメン法ではなく「レニウム」だけ覚えればよくなるかもしれませんね。
世界一のフェノール合成触媒
まとめ
クメン法はフェノールを作る工業的製法で、
ベンゼンとプロペンからフェノールとアセトンを作る方法でした。
クメン法の手順は、
①クメンを作る
②クメンを酸化する
③酸で分解してフェノールを得る
でしたね。
一番厄介に思うのは、
「クメンヒドロペルオキシド」の名前と構造の暗記でしょう。
しかしおそらく反応の意味を知っていれば、
構造はかなり覚えやすくなると思いますし、
名前も語源を考えればそのままです。
もし今の段階で不安があればもう一度復習し、
完璧にしてしまいましょう。















プロペンに水素の原子核がπ結合の電子を奪って付加した後に真ん中の炭素がプラスになる理由が分かりません。
その解説も私の理解力不足で分かりませんでした。教えてください。
また、そもそも水素の原子核がπ結合の電子を奪って不安定な形になることが理解できません。π結合の電子は水素と炭素で共有された方がエネルギーが低くなるってことですか?
π結合を奪った後に左の炭素にくっついたのは炭素原子に結合してる水素の数で決まってるっていう解釈で間違いないでしょうか?ならば、一番上の質問で真ん中がプラスになる理由も分かるのですが。
よろしくお願いします。
質問ありがとうございます。
質問は、
1.なぜプロペンの真ん中の炭素が+なのか
2.なぜ不安定な形になるのか
の2つだと思うので、順番に説明します。
1.なぜプロペンの真ん中の炭素が+なのか
後半に書いてもらった、
「π結合を奪った後に左の炭素にくっついたのは炭素原子に結合してる水素の数で決まってる」
という解釈で正しいです。
もしそれで納得感があればその理解で十分です(いわゆるマルコフニコフ則ですね)。
ちなみにこの記事の説明は、
「ではなぜ水素の数で決まるのか」
(なぜマルコフニコフ則が起こるのか)
をデフォルメして説明しています。
他サイトになりますが、
より詳しい説明を見つけたのでリンクを貼っておきますね。
カルボカチオンの安定性
2.なぜ不安定な形になるのか
陽イオンの状態はやはりエネルギーが高く、
プロペンの方がエネルギーが低いです。
しかし実は化学反応はエネルギーだけでは決まりません。
その例として酢酸を思い出してください。
酢酸の電離は吸熱反応だから、
電離したらエネルギーが高くなりますが、
実際一部の分子は電離しています。
実は、たくさんの酢酸分子が集まると、
予想できない様々な相互作用が起こることで、
酢酸全体の1%くらいは電離してしまうのです。
これと同様に、
プロペンのほとんどは分子状態だけれど、
確率的にほんの一部が陽イオン状態になり、
ベンゼンに攻撃してクメンができます。
こうして陽イオン状態の粒子が減ると、
ルシャトリエの原理が働くことで、
さらに陽イオン状態の粒子が増え、…
の連鎖によって反応が進んでいくのです。
以下は蛇足になるかもですが、
反応速度論の活性化エネルギーも似た考えですね。
粒子ごとにエネルギーの高低が違い、
たまたまエネルギーが高いものは化学反応を起こします。
考え方の本質はこれと同じです。
(より詳細、正確な考え方は、
統計力学(分子統計力学)の分野になるかと思います。)
こちらの説明不足が多々あり、
理解を妨げてすいません、
コメントを頂けると記事に反映できるのでとても嬉しいです。
ご回答ありがとうございます。
これまでここまで踏み込んだ質問をしても誤魔化されることが多かったため、今回も同じように流されると思っていました。こんなにも真摯に質問に答えてくれた方は初めてです。
これからも利用させていただきます。
いえいえ、
このような深い質問が来て、それ回答することで、
このサイトの価値も高まると思います。
(自分でも直さなきゃと感じる記事はありますし…)
これからも何かあればぜひコメントください!
クメン法でクメンの水素が離れて酸化しやすくなるところあるじゃないですか、そこで「フェノールと同じようにベンゼン環にくっついたプロピル基の真ん中の炭素は少し電子不足で温めると水素が離れていく」と書かれていますが、フェノールと同じなら水素イオンが離れていくのが普通じゃないんですか?さらに、真ん中の炭素が電子不足なのに炭素よりも電気陰性度が低い水素が電子を持っていくのは不自然と感じてしまいます。
よろしくお願いします。
確かにこれは図が非常に悪いですね…。
図は炭素陽イオンのようになっていますが、
ここはラジカルとして書く方が正確です。
(後日早急に訂正します。)
「フェノールと同じように…」
までの説明は問題無いです。
だから確かにH+が離れていきそうですが、
CはOほど電気陰性度が高くないので、
陰イオンにはなりきれずラジカル状態になります。
(ただし一つ前のコメントの返信同様、
完全にラジカルになるわけではなく、
確率的にそういう状態が存在するということです。)
このラジカルと酸素が反応することになります。
ありがとうございます。理解しました。
たびたび申し訳ないのですが、1つ確認したいことがあります。
クメンヒドロぺルオキシドからアセトンが脱離するところで
Qアセトンが剥がれるのはなぜ?のところにヘミアセタール構造の構造式が記載されていますが、他のサイトではヘミアセタールの構造はRCH(OH)(OR’)とあります。さらに、ヘミアセタールの意味を紹介しているサイトで、アセタールが二つのエーテル結合を持つのに対し、ヘミアセタールは一つのエーテル統合をもつ構造であるという記載がありました。その定義だとこのサイトに記載されている構造とは相違があります。
このサイトにある構造でもこれらの定義に当てはまっているのでしょうか。
ミスが多すぎますね…。
ご指摘の通りヘミアセタールはRCH(OH)(OR’)の形です。記事を修正しておきます。
実際フェノールができる直前もこの形ですね。
高校範囲では他には糖類の分野で出てきます。
ちなみに今回間違えて書いていたR1R2C(OH)2は「ジェミナルジオール」と呼ばれ、これも不安定です。
高校範囲ではニンヒドリンがこれにあたります。
ご指摘ありがとうございます!