再生繊維と半合成繊維、
違いを明確に説明できますか?
高校化学では最終盤に習う内容で、
答えられない人が多いのではないでしょうか。
実はこれらの違いは、
「セルロースをそのまま利用する」か、
「セルロースを化学反応させて利用する」か、
だけです。
ここでは、これらの違いに加え、
再生繊維と半合成繊維の製法も解説します。
この記事を最後まで読むことで、
再生繊維と半合成繊維を100%復習でき、
テストでも必ず得点できるようになります。
ぜひ読み飛ばさずに読んでみてください。
再生繊維と半合成繊維の違いは?
再生繊維と半合成繊維の違いを理解するためには、
「セルロース」の構造を復習する必要があります。
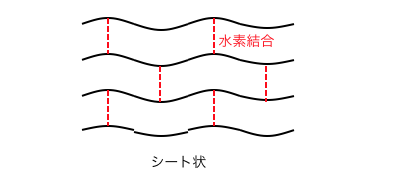
β-グルコースが重合したセルロースは、
分子内水素結合によってシート状になっているのでしたね。
よってセルロースは非常に頑丈で、
植物の細胞壁などに使われています。
そんなセルロースを繊維として用いるためには、
一度強烈な力でシート状構造を壊し、
それを繊維状に加工し直す必要があります。
天然のセルロースを一旦酸などに溶かし、
それを繊維状のセルロースに再生させたものが「再生繊維」です。
つまり再生繊維は立体構造が違うだけで、
セルロース自体の化学式は変わりません。
一方で、
天然のセルロースの一部を化学反応させてしまい、
繊維状に加工したものを「半合成繊維」と言います。
元は天然のセルロースだけど、
ちょっとだけ人工的に操作しているから、
「半分合成した繊維」ということで半合成繊維と呼ぶのです。
以上から、
・再生繊維=繊維状のセルロース
・半合成繊維=セルロースではない
(セルロースを化学反応させたもの)
という違いがあります。
違いがわかったところで、
それぞれの製法を確認していきましょう。
再生繊維、レーヨンの製法
セルロースを再生してできる繊維が、
「レーヨン」です。
名前は違えど、
レーヨン=繊維状セルロース
と思ってもらって構いません。
レーヨンは、一度酸などにセルロースを溶かし、
それを再生させることで作ります。
この時の溶かし方によって、
①銅アンモニアレーヨン
②ビスコースレーヨン
などの種類があります。
どちらも同じレーヨンですが、
製法が違うだけで名前が変わるのですね。
それではそれぞれの方法を確認してみましょう。
①銅アンモニアレーヨン
レーヨンは、
・セルロースの-OHと中和反応を起こす
・弱酸遊離反応でセルロースに戻す
という流れで作ります。
溶かして戻しているだけなんですね。
ただし-OHは単なるヒドロキシ基で、
その電離度は水よりも小さいから、
特別な薬品を使う必要があります。
そこで特別な薬品として、
CuSO4とNH3aqを混ぜた「シュバイツァー試薬」を使うのが、
「銅アンモニアレーヨン」です。
全く覚える必要はありませんが、
一応このときの反応式も書いておきます。
シュバイツァー試薬の主成分は[Cu(NH3)4](OH)2で、
錯イオンが-O–にくっつく形で反応します。
\mathrm{ 2(C_{6}H_{10}O_{5})_{n} + n[Cu(NH_{3})_{4}](OH)_{2} }\\
→\mathrm{ \{(C_{6}H_{9}O_{5})_{2}[Cu(NH_{3})_{4}]\}_{n} + 2nH_{2}O }
\end{align*}
このようにして溶かしたものに、
希硫酸をいれて弱酸遊離反応を起こしながら、
糸状にすると銅アンモニアレーヨンが得られます。
\mathrm{ \{(C_{6}H_{9}O_{5})_{2}[Cu(NH_{3})_{4}]\}_{n} + 3nH_{2}SO_{4} } \\
→\mathrm{ 2(C_{6}H_{10}O_{5})_{n} + nCuSO_{4} + 2n(NH_{4})2SO_{4} }
\end{align*}
②ビスコースレーヨン
基本は銅アンモニアレーヨンと同じで、
セルロースの溶かし方が違うのが、
「ビスコースレーヨン」です。
セルロースに濃NaOHaq+二硫化炭素CS2を加えると、
「ビスコース」という物質になって溶けます。
具体的な構造式は省略しますが、
-OH基にCS2がくっついたような構造になっています。
ビスコースに希硫酸を加えながら、
糸状にするとビスコースレーヨンが得られます。
繰り返しになりますが、
①と②の違いは溶かし方であることに注意しましょう。
半合成繊維、アセテートの製法
セルロースの-OH基に化学反応を起こし、
立体構造を壊した上で繊維状に加工するのが半合成繊維でした。
半合成繊維のうち、
-OH基をアセチル化するものを「アセテート」といいます。
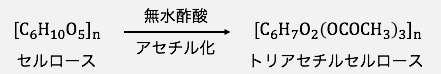
まずは材料のセルロースに、
無水酢酸を加えることでトリアセチルセルロースを作ります。
これをアセトンに溶かすのですが、
このままでは溶かすことができません。
そこで一部の-OCOCH3を加水分解して、
ジアセチルセルロースにすることで、
アセトンに溶かすことができます。

これを温かい空気中に噴出させて、
糸状に加工した後にアセトンを蒸発させると、
「アセテート」が得られます。
再生繊維とは違い、
いくつかの-OH基が-OCOCH3に変化していることに注意しましょう。
ジアセチルセルロースからできたアセテートは、
適度に-OH基を含むことによって、
適度な吸湿性を持っています。
トリアセテートは耐熱性に優れる一方、-OH基がなくなることで吸湿性が悪くなります。
まとめ
再生繊維と半合成繊維の違いはわかりましたか?
違いをもう一度まとめると、
・再生繊維=繊維状のセルロース
・半合成繊維=セルロースではない
(セルロースを化学反応させたもの)
でしたね。
また、再生繊維であるレーヨンは、
セルロースの溶かし方によって種類が変わるのでした。
この分野は勉強時間もなかなか取れず、
曖昧になっていることが多いですが、
一度まとめて見ておけばかなり身につきます。
まだ不安がある場合は、
この機会に復習しきってしまいましょう。













シュワイツァー試薬のところなのですが、Cu(OH)₂ではなくCu₂SO₄でいいんですか…?
まずはじめに訂正ですが、
誤:Cu2SO4→正:誤:CuSO4
でした。混乱させてすいません。
では本題のシュバイツァー試薬ですが、
結論から言えばCuSO4でもCu(OH)2でもOKです。
シュバイツァー試薬は、
①CuSO4にNaOHかNH3を入れ、Cu(OH)2沈殿を作る
②沈殿を取り出し、濃NH3を加えて[Cu(NH3)4]2+を作る
と言う手順で作ります。
この流れを見ればわかる通り、
仮に材料としてCu(OH)2を用意しても、
そこにNH3を加えればシュバイツァー試薬として働きます。
ではなぜわざわざCuSO4を使うかというと、
Cu(OH)2には不純物(酸化物や塩基性塩など)が混ざっている可能性があるからです。
だから実際にはCuSO4から沈殿させることで、
その場Cu(OH)2を作ります。
しかし入試的にはここまで細かくは覚えなくていいので、
記事では①②を省略して「CuSO4にNH3」としました。
(一番大事なのは[Cu(NH3)4]2+が生じるところですからね)