「なんでフェノールは酸性なの?」
「ナトリウムフェノキシドにNaHCO3を入れると、
なんでフェノールが生じるの?」
「塩化鉄で呈色?置換反応??結局何が起こるの?」
あなたもこのように感じたことはありませんか?
フェノール類は本当にさまざまな反応を起こすため、
全て覚えきるのは難しいものです。
フェノールの製法や反応が覚えられないのは、
ベンゼン環の本質的な知識が身についていないからです。
ここではフェノールの性質を理解するための、
本質的な知識をお伝えします。
ここでお伝えする知識を身につけることで、
フェノールの製法や反応が「仕組み」から理解でき、
何度も復習しなくても自然と反応を覚えてしまうでしょう。
これまでやってきたことが「丸暗記」だったなと感じることでしょう。
本質的な知識なしに勉強を進めても、
なかなか点数につながらないばかりか勉強が苦痛になってしまいます。
本質的な知識があるからこそ、
有機化学の問題がどんどん解けるようになっていくのです。
目次
フェノールとは
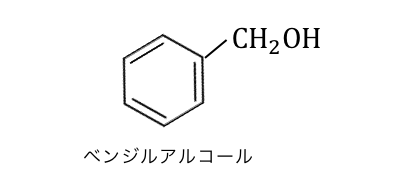
「フェノール」とは、ベンゼン環にヒドロキシ基-OHが直接くっついた化合物です。
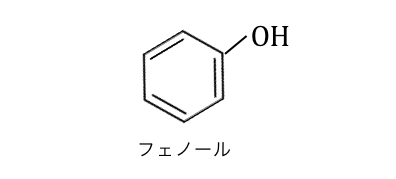
フェノールと言ったときにはベンゼン環に「直接」くっついている必要があります。
以下のように同じ分子式の物質でも、
o-クレゾールはフェノール類ですがベンジルアルコールはアルコールです。
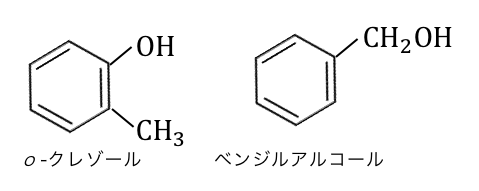
フェノールを理解するためには、
ベンゼンの性質を知っていることが必要不可欠です。
「単結合と二重結合が交互にある化合物だよね」
「ベンゼンってなんで置換反応が起こるんだろう」
「でも時々付加反応も起こる、ややこしい」
こんなふうに思っているあなたは、
おそらくベンゼンの本質を知りません。
フェノールの内容に入る前に、
必ず以下の記事を読んでおきましょう。
フェノールの製法
フェノールを製法の1つに「クメン法」がありましたね。
とっても複雑な反応でした。
なぜあんなに複雑なことをしないといけないのでしょうか?
これはベンゼンの反応の仕組みを思い出せばすぐにわかります。
ベンゼンは6つの炭素で電子を共有して持つことで、
「電子の雲」のようなものを持っているのでした。
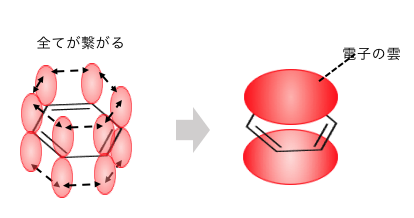
だからベンゼンの反応の基本は「陽イオンによる攻撃」でしたよね。
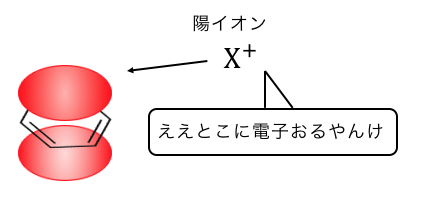
これからもわかるように、
「電子の雲」を持つベンゼンにOH–を投げても、
マイナス同士だから弾かれてしまうのです。
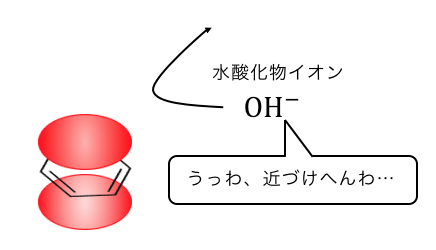
うまいことやってこの問題を解決したいから、
どうしても反応が複雑になってしまうのです。
この問題を解決してフェノールを作る方法として、
①アルカリ融解
②クロロベンゼンを利用する方法
③クメン法
があります。
①アルカリ融解
「アルカリ融解」とは、
ベンゼンスルホン酸に高温高圧でNaOHをぶつけて、
フェノールを作る方法です。
先ほども説明した通り、
ベンゼンには「電子の雲」がいるせいで、
ヒドロキシ基OH–が近寄れません。
そんなときに登場するのがスルホ基。
スルホ基を構成する硫黄Sと酸素Oは、
炭素原子よりも電気陰性度が高く電子を欲しがっています。
そんなスルホ基をくっつけることで、
ベンゼンの「電子の雲」を少し吸い取ることができるのです。
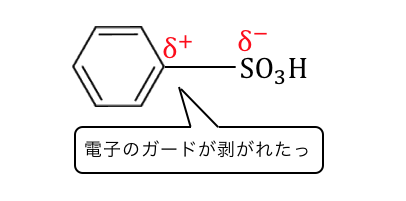
こうしてできた「穴」に、
高温高圧でNaOHを投げつけることでフェノールを作ります。
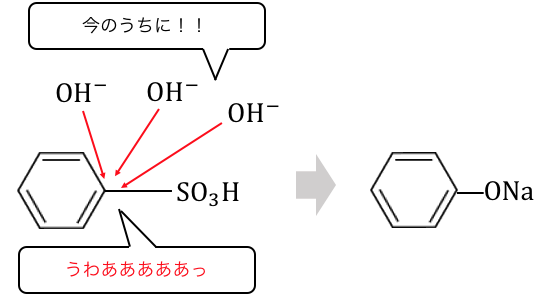
ただしフェノールができた瞬間に、
周りのNaOHと中和するので実際にできるのは「ナトリウムフェノキシド」です。
フェノールはかなり弱い酸なので、
「弱酸遊離反応」を利用してフェノールを遊離させます。
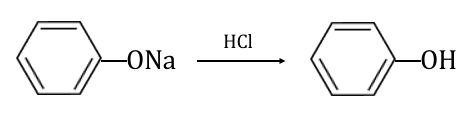
これによってフェノールが得られました。
②クロロベンゼンを利用する方法
アルカリ融解からわかったように、
電子を吸い取る官能基をつけてあげればいいのですね。
クロロベンゼンも簡単に作ることができた上に、
電気陰性度の強いClがくっついていますね。
このことから、
先ほどと同じように高温高圧でNaOHを入れることで、
ナトリウムフェノキシドを作ることができます。
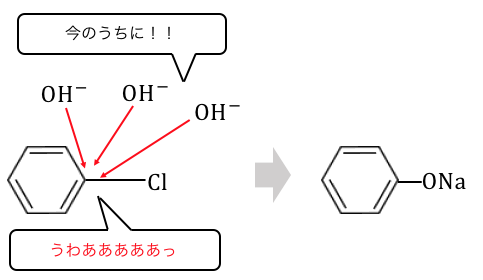
①と②は同じような仕組みだったのですね。
③クメン法
①②の方法が単純な方法ですが、
高温高圧にしないといけないのでコストがかかってしまいます。
そこで現在では「クメン法」が工業的製法として用いられています。
クメン法は以下の流れでフェノールを作ります。
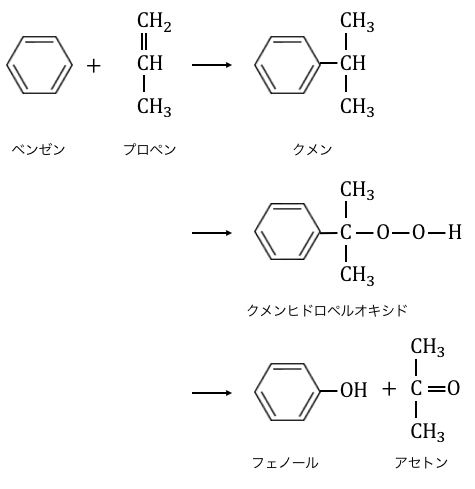
とっても複雑な手順を踏んでいますが、
その分低コストで作ることができるのです。
クメン法のより詳しい反応の手順は以下で説明するので、
そちらをごらんください。
フェノールの性質
ヒドロキシ基-OHを持つアルコールは「中性」でしたが、
同じ-OHを持つフェノールは「弱い酸性」です。
このような違いがなぜ起こるのかを考えていきましょう。
フェノールが酸性になる理由
アルコールは以下のように電離しますが、
その電離定数が水より小さいため中性です。
アルコールは-OHを持つのに、
塩基ではなく酸として働くのですね。
これは水素の電気陰性度が炭素より低く、
炭素Cと酸素Oの間より酸素Oと水素Hの間の方が電離しやすいからです。
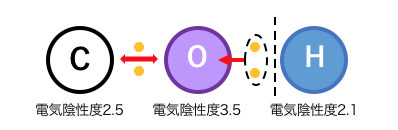
【合わせてチェック】
・アルコール・エーテルの性質を完全攻略!
フェノールの場合はどうでしょうか。
フェノールはただのアルコールとは違って、
すぐ近くにベンゼンの「電子の雲」があります。
そんなベンゼンの隣に結合した酸素Oは、
非共有電子対を電子の雲に吸い取られてしまうのです。
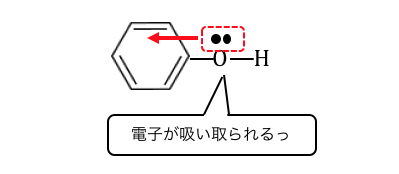
酸素Oだって電子を取られたくありませんから、
より電気陰性度の低い水素Hからもっと電子を引っ張ります。
その結果アルコールの時よりも水素が電離しやすくなるのです。
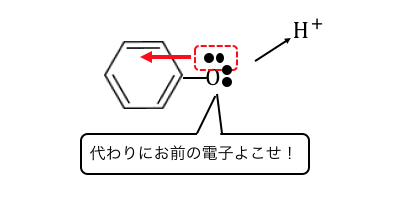
ベンゼン環がいることによって酸性になっているのですね。
酸素は電気陰性度が高いのでその感覚は正しいです。-Clや-SO3Hは吸い取っていましたしね。ただし酸素は炭素と同周期であり、非共有電子対が「電子の雲」に参加しやすいので電子を吸い取られてしまいます。
参考:配向性
少しだけレベルの高い話をするので、
必要ないと感じる人は飛ばしてしまって構いません。
先ほども説明した通り、
「電子の雲」が酸素から電子を吸い取ります。
その結果炭素と酸素が二重結合を作るような形になります。
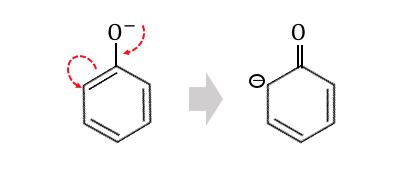
ベンゼンの中に電子が1個増えて、
マイナスイオン状態の炭素があります。
これはさらに以下のように移り変わります。
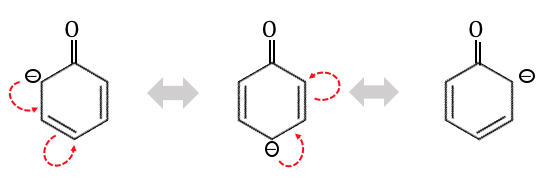
これによってo位とp位の反応性が上がっています。
よってフェノールはo位とp位で置換反応を起こしやすいのです。
これを「オルト-パラ配向性」といいます。
フェノールの反応
それではフェノールの反応を見ていきましょう。
フェノールの主な反応は、
①酸としての反応
②置換反応
③エステル化
④検出反応
です。
①酸としての反応
通常の酸で起こる反応が起こります。
C6H5OH+NaOH→C6H5ONa+H2O
(弱酸遊離反応)
C6H5ONa+CO2+H2O→C6H5OH+NaHCO3
フェノールはかなり弱い酸なので、
炭酸に対しても遊離してしまいます。
炭酸はカルボン酸より弱くフェノールより強いため、
この反応はフェノールの検出にも用いられますね。
②置換反応
フェノールはオルト位とパラ位の反応性が高く、
以下のような「ブロモ化」や「ニトロ化」を起こします。
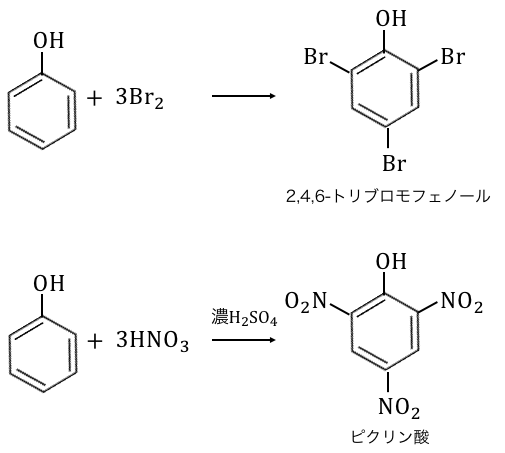
2,4,6-トリブロモフェノールは白色沈殿、
ピクリン酸は黄色沈殿です。
ニトロ基がベンゼン環から電子を吸い取り、
ベンゼン環が酸素からさらに電子を吸い取るので、
カルボン酸を超える酸性になります。
また、可愛い名前のピクリン酸ですが、
ニトロ基が3つも付いていることからもわかるように、
非常に強力な爆薬です。
間違って合成しないようにしましょう。
③エステル化(アセチル化)
フェノールはヒドロキシ基-OHを持っているので、
カルボン酸とエステル化を起こすことができます。
ただし、
カルボン酸に-OHが攻撃してエステル化が進みましたが、
フェノールの-OHは電子を吸い取られて元気がありません。
よってエステル化をするためには、
無水酢酸によって無理矢理起こす必要があります。
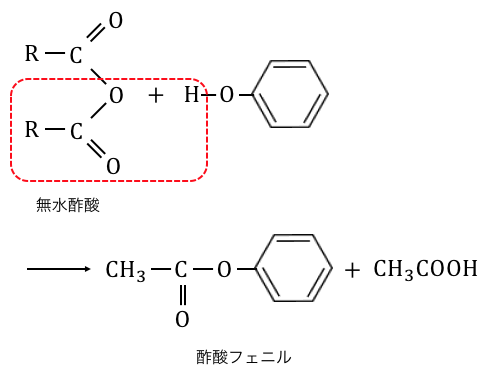
④検出反応
最後に検出反応です。
フェノールに「塩化鉄(Ⅲ)」を加えると紫色に呈色します。
以下のように錯イオンを作るのですが、
反応式自体は覚える必要はありません。
この反応が起こるのは、
ベンゼン環に直接-OHがくっついた場合のみです。
最初にも言ったように、
ベンジルアルコールなどはフェノールではないので、
呈色反応は起こせません。
フェノールが電離した形で、
配位子になっていることからも当然ですね。
構造決定でも頻繁に利用されるので、
きっちりと押さえておきましょう。
参考:フェノールフタレイン

無水フタル酸とフェノールを反応させると、
「フェノールフタレイン」ができます。
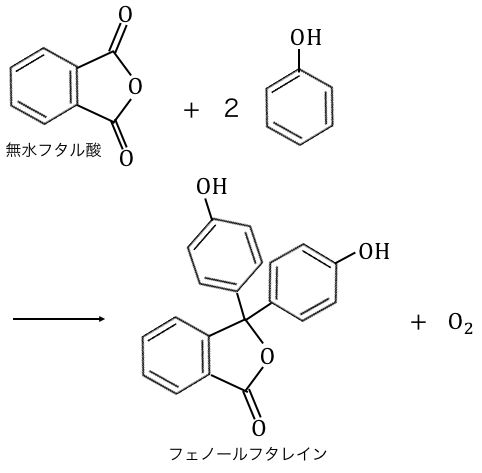
フェノールフタレインといえば、
中和滴定などで用いる試薬でした。
構造式はテストには出ませんが、
「無水フタル酸」と「フェノール」という、
高校化学お馴染みの物質からできていたのですね。
フェノールフタレインは、
液性によって以下のように変化します。
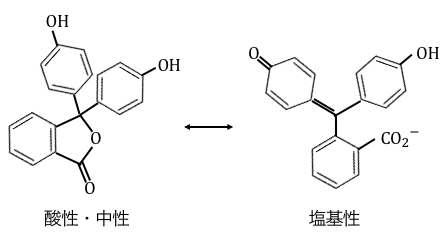
このように有機化合物の構造が変化することで、
色に変化が出るのです。
化学反応や物性だけでなく、
高校化学では丸暗記することにもきっちりと理由があるのですね。
まとめ
今回はフェノールの解説でした。
ベンゼン環は「電子の雲」で守られていて、
そのせいでOH–を単純にぶつけることはできません。
そのため、
①アルカリ融解
②クロロベンゼンを利用する方法
③クメン法
などの工夫をしたのでした。
また、通常はなかなか電離しないヒドロキシ基が、
ベンゼン環につながることで電子を吸い取られ、
電離しやすくなるのがフェノールの本質でしたね。
この性質により、
①酸としての反応
②置換反応
③エステル化
④検出反応
を起こすのでした。
かなり盛りだくさんな内容でしたが、
きっちりと仕組みを考えればかなり覚えやすいと思います。
何度か復習して完璧にしてしまいましょう。














コメントを書く