有機化合物の分離はセンター頻出です。
ここでミスをしてしまっては、
他の受験生と差がついてしまいます。
今回は芳香族化合物の分離の解説です。
それぞれの操作の意味を理解することで、
絶対に忘れない状態にしてしまいましょう。
また大学で有機化学の実験をするときには頻繁に行う操作です。
リアルな実験を想像しながら読んでみると面白いと思います。
目次
有機化合物の分離とは
有機化合物は有機溶媒に溶けやすく、
有機化合物の塩は極性溶媒に溶けやすいです。
これを利用して有機化合物を分離する方法が、
「溶媒抽出法」です。
混合物を分離する方法として、
ろ過、蒸留、分留、再結晶法、昇華法、クロマトグラフィ
などを一番初めに習ったと思います。
この溶媒抽出法はそこで「抽出」として習ったものを、
混合した有機化合物の分離に利用したものです。
有機化合物の分離の仕組み
具体的にどのような仕組みで分離していくのかを確認していきましょう。
用いる実験器具
有機化合物の分離に用いるのが「分液漏斗」です。
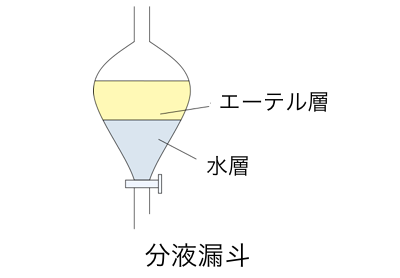
分液漏斗に水と有機溶媒を入れると、
互いに溶け合わずに2つの層ができます。
水の層を「水層」、有機溶媒の層を「エーテル層」、
もしくは上の層を「上層」、下の層の「下層」、
と言います。
水層とエーテル層のどちらが上になるかは、
有機溶媒の比重によって変わってきます。
エーテル層は、
ジエチルエーテルなど水より比重が低いものなら上層、
クロロホルムCHCl3などの水より比重が高いものなら下層になります。
入試ではジエチルエーテルを用いる場合が多く、
エーテル層が上になっている場合が多いですが、
上層・下層と言われた場合は比重から判断するので、
注意しましょう。
溶媒抽出法の仕組み
溶媒抽出法の仕組みは、「中和反応」と「弱酸遊離反応」です。
基本的にエーテル層に溶けている有機化合物も、
中和反応で塩にすることによって水層に移すことができます。
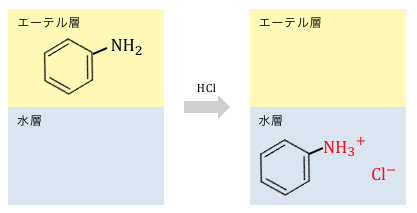
しかし、例えばフェノールと安息香酸のように、
同じ液性のものがあって同時に中和されてしまうと、
うまく分離することができません。
そこで酸の強さを利用して、
狙った有機化合物だけを反応させるのです。
これは弱酸遊離反応と同じ仕組みですね。
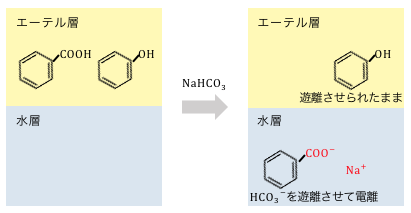
以上の仕組みを利用して、
有機化合物を分離していくのです。
有機化合物の分離の流れ
高校で習う芳香族有機化合物のうち、
基本的なものを以下にまとめます。
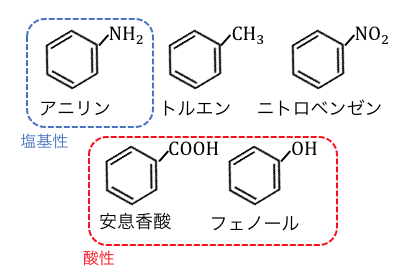
これらの分離の流れを見ていきます。
①塩酸HClを入れる
これらのうちで塩基性であるのはアニリンだけなので、
塩酸を入れることで水槽へ分離します。
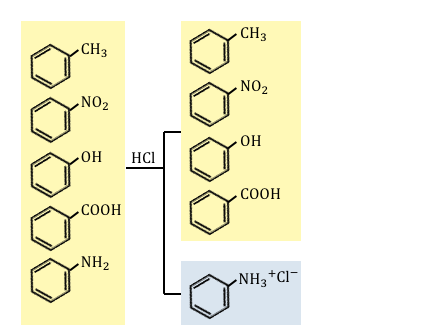
水層を取り出してあげて、
そこにNaOHなどを加えてあげれば、
弱塩基遊離反応でアニリンを取り出すことができます。
②炭酸水素ナトリウムNaHCO3を入れる
塩基性の物質がなくなったので、
次は酸性の物質を分離していきます。
しかし酸性の物質は、
フェノールと安息香酸の2種類があります。
うまく片方だけ遊離させるために、
フェノール以上、カルボン酸以下の酸である、
NaHCO3を入れましょう。
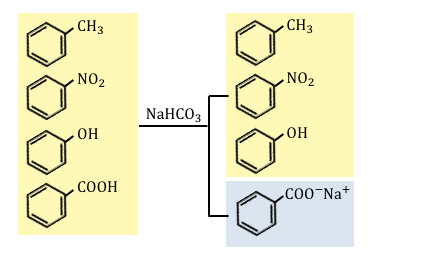
NaHCO3より強い安息香酸は塩になって水層へ移り、
NaHCO3より弱いフェノールは塩にはならず遊離させられたままです。
水層に移った安息香酸ナトリウムは、
塩酸などを加えることによって取り出すことができます。
③水酸化ナトリウムNaOHを入れる
ここまでいけば残る酸はフェノールしかありません。
もう酸の強さを気にする必要はないので、
水酸化ナトリウムで一気に中和させてしまいます。
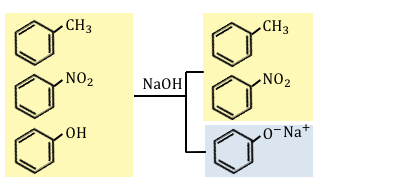
この水層に塩酸を入れればフェノールが得られますね。
④残った中性物質は分留する
塩基性、酸性のものは全て取り除いたので、
残るは中性物質しかありません。
これ以上はどうにもならないので、
最後は「分留」で分けてあげます。
溶媒抽出法まとめ
以上の流れをまとめると以下の通り。
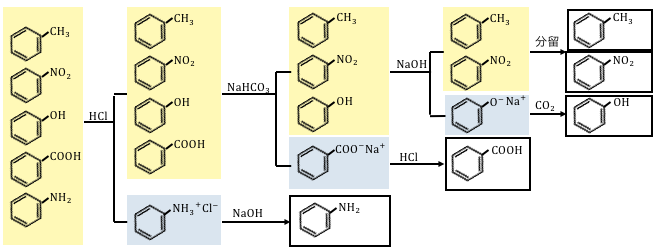
センターでも問われる必須知識なので、
きっちりと理解しておきましょう。
参考:実際の実験における注意点
有機化合物の分離は、
有機合成の場面で頻繁に必要になる操作です。
高校で習う分には比較的単純ですが、
実際の実験ではいろいろ細かい注意点があります。
ここではその一部を紹介しておきましょう。
実際の実験の雰囲気を感じられたらいいなと思います。
分液漏斗の扱い
分液漏斗に薬品を入れた後には、
分液漏斗を振りまぜることで有機化合物に酸や塩基を反応させます。
有機溶媒はとても蒸発しやすいので、
振っている間に分液漏斗内の圧力が上昇してしまいます。
NaHCO3を入れた場合はCO2も発生し、
より圧力が高まってしまいますね。
そのためときどき分液漏斗の栓を開けて、
ガス抜きをしてあげる必要があります。
有機溶媒からの脱水
いくら水層とエーテル層が混ざらないとは言え、
分液漏斗を振り混ぜれば少しは水が混ざってしまいます。
これによって分離したエーテル層には、
意外と水が残っているのです。
だから実際の実験では、
乾燥剤として硫化マグネシウムを加えることで脱水をします。
固体の有機化合物を得る
最後にエーテル層に1つの物質を分離できた後、
それを固体として取り出したいです。
有機溶媒は蒸発しやすいので、
「エバポレータ」などを利用して有機溶媒を蒸発させ、
目的の有機化合物を固体として取り出します。
エバポレータはフラスコ内を減圧することで、
溶媒の蒸発を促す機械です。
実験は意外に大変ですね。
まとめ
今回は有機化合物の分離法である「溶媒抽出法」の解説でした。
有機化合物は有機溶媒に溶けやすいですが、
塩になれば水に溶けることを利用して分離する方法でしたね。
具体的には、
①塩酸HClを入れる
②炭酸水素ナトリウムNaHCO3を入れる
③水酸化ナトリウムNaOHを入れる
④残った中性物質は分留する
の流れで分離するのでした。
もう一度流れをまとめた図を示しておきます。

意味を理解して入れば大した知識量でもないので、
今すぐ覚えきってしまいましょう。














「ジメチルエーテルなど水より比重が低いものなら上層」、
「入試ではジメチルエーテルを用いる場合が多く」
と記載がありますが、
ジメチルエーテルは、沸点–23.6 ºCの気体ですので、ジエチルエーテル(Et2O)の誤りであると思われます。
わ、本当ですね、ご指摘ありがとうございます。
(センター試験でメタンとエタンを読み間違えたことを思い出しました…)
訂正しておきます!