以前の熱化学方程式の記事には、
かなりの人が興味を持ってくれたようです。
しかし前回の記事は初心者向けだったので、
エネルギー図の練習は不十分だったと思います。
そこで今回の記事では、
エネルギー図の書き方を復習した上で、
エネルギー図習得に十分な演習問題を用意しました。
かなりボリュームのある記事ですが、
この記事を最後まで読むだけで、
熱化学方程式が得意科目になることでしょう。
ぜひ紙とペンを用意して、
一緒に解きながら勉強していきましょう。
目次
エネルギー図の書き方
たった2つの事実を理解していれば、
エネルギー図は簡単に書くことができます。
それは、
①エネルギーの高低を覚える
②エネルギー・熱の意味を理解する
です。
言葉だけ聞いてもわからないと思うので、
それぞれ順番に意味を確認します。
①エネルギーの高低を覚える
例えば酸素原子Oの状態よりも、
O2やH2Oの方が安定に存在します。
さらに化合物の中でも、
黒鉛CはCO2よりエネルギーが高いので、
燃えてCO2になりやすいですね。
このように、
物質のエネルギーの高低は決まっています。
エネルギーの高低は以下の順番になります。

まずはこれを覚える必要があるのですが、
具体例をイメージすればそんなに大変じゃないです。
例えば、
自然界には単体より化合物が多いですから、
単体 > 化合物と想像できそうですし、
物が燃えれば熱放出して燃焼物になるので、
化合物 > 完全燃焼物になります。
もちろん単体より原子状態は不安定だし、
電荷の偏りが出ればさらに不安定ですから、
イオン > 原子 > 単体です。
まあとにかく、
具体例をイメージするにしてもしないにしても、
まずはこのエネルギーの順番を覚えておきましょう。
酸化数が最大になるまで酸化された化合物と考えれば良いです。CO2は完全燃焼物として扱いますが、COは化合物として扱います。
②エネルギー・熱の意味を理解する
化学の世界では、
エネルギーとは「必要なエネルギー」を意味し、
熱は「放出するエネルギー」を意味します。
エネルギーは与える物、熱は捨てるものであり、
エネルギーを与えればエネルギーが高くなり、
熱を捨てればエネルギーが低くなります。
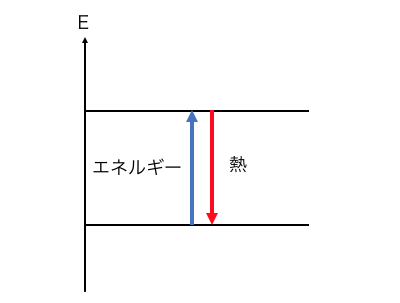
結合エネルギーによって単体→原子になり、
燃焼熱を放出して化合物→完全燃焼物になる、
と言うことからも想像できると思います。
エネルギー図を書く上でかなり重要なので、
よーく頭に残しておいてください。
つまり、
・燃焼熱
・生成熱
・溶解熱
など「熱」がつくものは下矢印、
・結合エネルギー
・格子エネルギー
・イオン化エネルギー
など「エネルギー」がつくものは上矢印で書きます。
これらを一つの図にまとめると以下の通り。
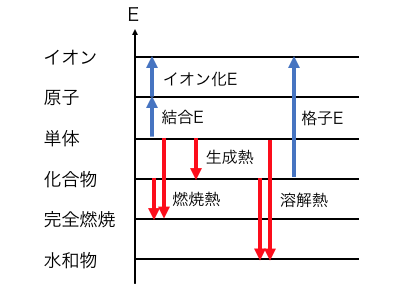
この図はわざわざ覚えなくても、
問題文を読めばその場で作れます。
まとめれば、
・エネルギーの順番
・エネルギーは上矢印、熱は下矢印
を覚えることでエネルギー図を書く準備は完了です。
一緒にエネルギー図を書いてみよう!
それでは実際の問題を使って、
一緒にエネルギー図を書いてみましょう。
この記事を目で眺めるだけでもいいですが、
できれば自分のノートに書いてみるといいです。
今回の例題は以下の通りです。
エタンの生成熱を求めよ。ただし固体炭素C、水素H2、エタンC2H6の燃焼熱はそれぞれ394kJ/mol、286kJ/mol、1560kJ/molとする。
①まずは求めたい熱の式を書き込む
エネルギー図に書き込んでいくのですが、
まずは先ほど覚えたエネルギーの順を書きます。
今回は単体、化合物、完全燃焼物だけなので、
以下のようなエネルギー図の型を用意します。
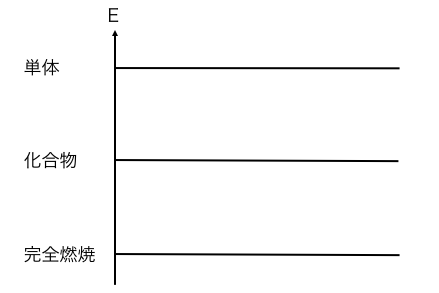
早速ここに求めたい熱を含む式を書きます。
求めたいのは生成熱なので、矢印は下向きです。
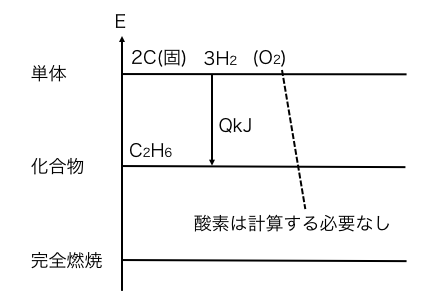
②次に残りの式を書き込む
それでは残りの式も書き込みましょう。
まずはH2の燃焼熱。
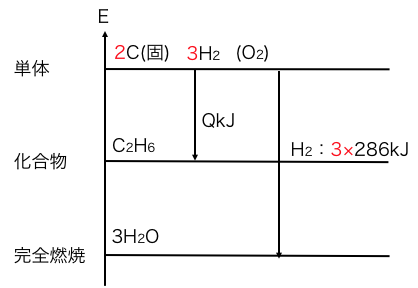
次にCの燃焼熱。
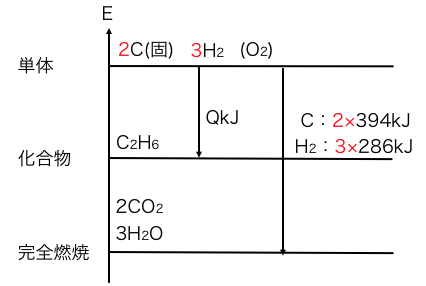
単体の段階から完全燃焼物に行くには、
2つのCと3つのH2を燃やすので、
それらの燃焼熱の合計が放出されます。
最後にエタンの燃焼熱。
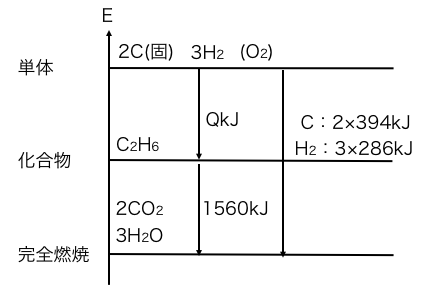
これによってエネルギー図完成です。
③図から方程式を立てて解く
ここまで来たら問題は解けたも同然!
エネルギー図を見て方程式を立て、
実際にQを求めましょう。
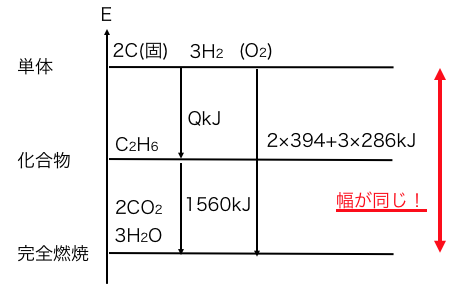
\begin{align*}
\mathrm{ Q + 1560 } &\mathrm{ = 2\times394 + 3\times286 } \\
\mathrm{ Q } &\mathrm{ = 86 }
\end{align*}
補足:エネルギー図はいつでも書ける?
エネルギー図は「ヘスの法則」を根拠にしています。
ある物質からある物質への反応熱は、
反応の経路によらない、と言う法則です。
だから基本的にはどんな問題もエネルギー図で解くことができます。
ただ少し「??」となるパターンもあるので、
それは次の演習問題の中で確認しましょう。
演習問題
今回は基礎的なものから難し目なものまで、
少し多めに問題を用意しておきました。
ここの問題をきちんと解くことができれば、
エネルギー図はもう完璧でしょう。
ぜひ自分で解いてみてください。
①結合エネルギーと反応熱
(解答)
求めたい結合エネルギーをQとして、
原子、単体、化合物のエネルギー図に、
アンモニアの解離反応を書き込みます。
アンモニアにはN-Hが3つあることに注意です。
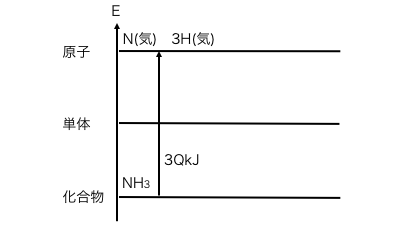
次に水素、窒素の解離を、
両方一気に書いてしまいます。
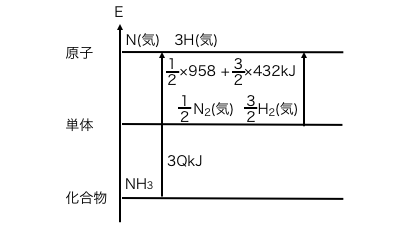
最後にアンモニアの生成熱を書きます。
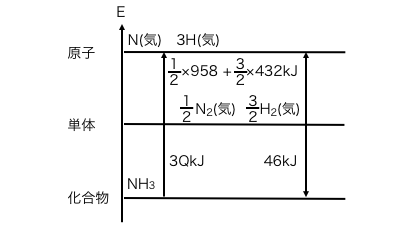
以上を計算すれば、
\(\mathrm{ 3Q = (\frac{1}{2}\times958+\frac{3}{2}\times432)+46 }\)
\(\mathrm{ Q = 391kJ}\)
②結合エネルギーと反応熱
\(\mathrm{ 2C(固) + 3H_{2} = C_{2}H_{6} + 84kJ }\)
\(\mathrm{ C(固) = C(気) – 715kJ }\)
またC=Cの結合エネルギーが590kJの時、以下の反応熱Qも求めよ。
\(\mathrm{ C_{2}H_{4} + H_{2} = C_{2}H_{6} + QkJ }\)
(解答)
求めたい結合エネルギーをqとして、
原子、単体、化合物のエネルギー図に、
エタンの解離反応を書き込みます。
C-Cは1つ、C-Hは6つあることに注意です。
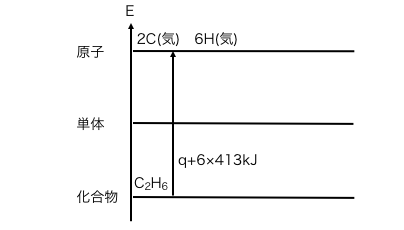
次に水素炭素のの解離を一気に書きます。
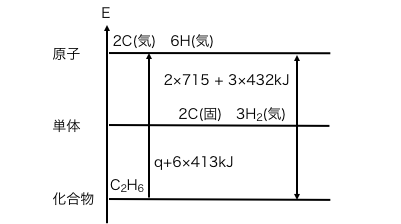
最後にエタンの生成熱を書きます。
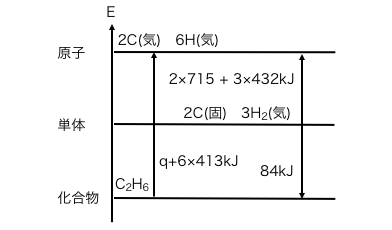
以上を計算すれば、
\(\mathrm{ q + 6\times413 = (2\times715+3\times432)+84 }\)
\(\mathrm{ q = 332kJ}\)
次にQを求めるのですが、
ここではヘスの法則を体感するために、
少しだけ違う考え方も紹介します。
以下のように左辺と右辺のエネルギーを考え、
その差分がQになる、と考えます。
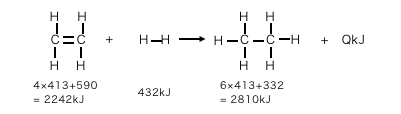
\(\mathrm{ Q = 2810 – (2242+432) }\)
\(\mathrm{ Q = 136kJ}\)
一旦全部バラバラにして再構成すると、
Qだけエネルギーが余るイメージです。
このようにみると、
熱化学方程式を「=」で書く意味が見えてきますね。
③生成熱と反応熱
今回は少しイレギュラーなパターンです。
ただしエネルギー図の意味が理解できていれば、
今までの知識でも十分解くことができます。
\(\mathrm{ H_{2} + \frac{1}{2}O_{2} = H_{2}O(気) + 242kJ }\)
\(\mathrm{ NH_{3} + \frac{3}{4}O_{2} = \frac{1}{2}N_{2} + \frac{3}{2}H_{2}O(気) + 317kJ }\)
\(\mathrm{ N_{2} + O_{2} = 2NO – 180kJ }\)
\(\mathrm{ 4NH_{3} + 5O_{2} = 4NO + 6H_{2}O(気) + QkJ }\)
(解答)
求めたい生成熱をqとして、
単体、化合物、完全燃焼物のエネルギー図に、
アンモニアの生成反応を書き込みます。
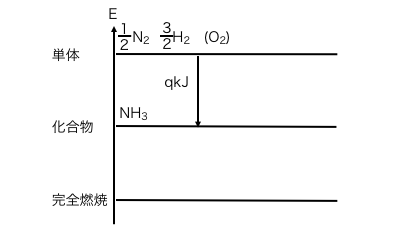
次に水素の燃焼反応を書きます。
しかし今回は窒素が燃焼しないことに注意です。
イレギュラーですが窒素は変化させずに移動させます。
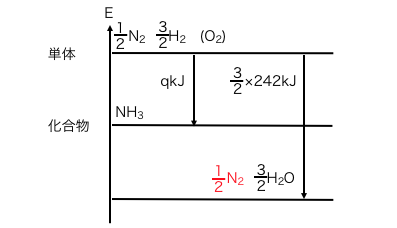
一瞬変な感じもしますが、
放出している熱と物質の変化が対応しているので、
本質的には問題ありません。
そして最後にアンモニアの燃焼です。
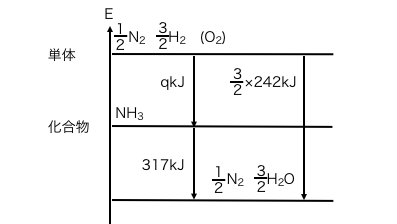
これを計算すれば、
\(\mathrm{ q + 317 = \frac{3}{2}\times242 }\)
\(\mathrm{ q = 46kJ}\)
次にQですが、
この反応はアンモニアからNOと水が生じます。
先ほどのアンモニアからN2と水が生じるのとは、
もちろんエネルギー的に違いますから、
図にもう一つエネルギーを作ってしまいます。
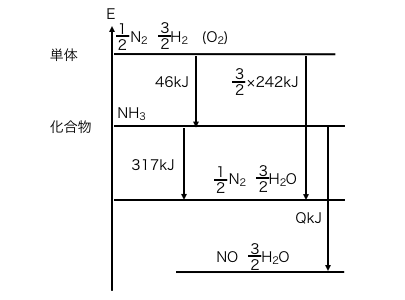
そして3つ目の式も書き込んでしまいます。
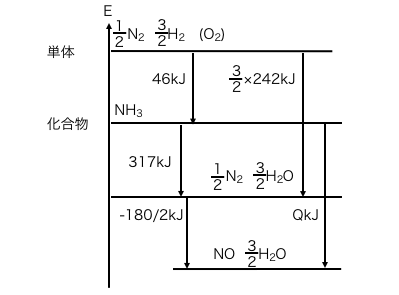
以上の図より、
\(\mathrm{ Q = 317 + (-\frac{180}{2}) }\)
\(\mathrm{ q = 227kJ}\)
最後の問題の補足
最後にエネルギー図の本質的なところを説明しておきます。
まだエネルギー図に慣れていない人は、
とりあえず①②や、手元の簡単な問題で慣れてから読んでください。
ある程度形式的に問題が解けるように、
エネルギーの6段階を基本に考えました。
しかし正確には、
例えば以下のような扱い方もできます。
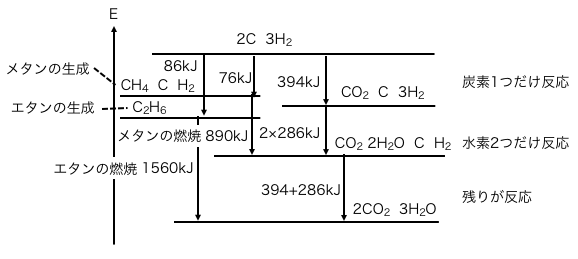
注意:
この図はただ数字遊びをしているだけで、
深い意味がある図ではありません。
ヘスの法則より、
反応熱は反応経路によらないから、
化学反応に対応した熱を書き込んでいけば、
自由にエネルギー図が書けるのです。
最初のうちはこの意味がわからなくていいので、
エネルギー図に慣れてきたらもう一度考えてみてください。
まとめ
今回は大ボリュームの記事でしたね。
この内容を理解するだけで、
熱化学方程式は得意分野になることでしょう。
エネルギー図を理解していれば、
仮に数式的に解こうとした場合でも、
解法の指針が明確に立つようになります。
逆にエネルギー図を知らないと、
闇雲に計算をして、間違えても理由がわからない、
という状態に陥ります。
ぜひ練習問題を通して、
きっちりと理解していってください。













②結合エネルギーと反応熱の一番最後の問題のエチレンの持っているエネルギーの値が違いますよ
③の生成熱と反応熱の3番目の式が間違っていました
もっと早くこのサイトを知っていればよかった…
自分の知っている凡ゆるサイトの中でダントツにわかりやすいです。
原理などの説明だけでなく、理解を深める為の演習問題までついていて非の打ち所がないです。偶にある誤植が気になりますがw これからも利用させていただきます!
嬉しいコメント、ありがとうございます
度々のミス申し訳ないです…笑
ご指摘いただき本当にありがとうございます!
一人でやってるのでチェックが行き届かず結構なミスがありますので、
このようなご指摘が本当にありがたいです…笑
(時々チェックはするのですが…)
質問です。
②の問題で、q+6×413になる理由が分かりません。
お手数ですが、教えていただけませんか?
よろしくお願いします。
まずはエタンの構造式を書いてみましょう。
エタンはC-Cの結合とC-Hの結合
のみからできています。
そして構造式から各結合の数を数えると、
C-C結合が1つ、C-H結合が6つあります。
C-C結合を切るエネルギーがq、
C-H結合を切るエネルギーが413なので、
合計でq+6×413のエネルギーが必要になります。
手元に構造式を書いて考えてみてください。
3つ目の問題の後半でQを求める部分が分かりません。
アンモニアと酸素の熱化学方程式ではアンモニア4molに対してQkJとなっているはずですが、
エネルギー図ではアンモニア1molでQkJという風になっていませんか?
エネルギー図に書き込まれているQをQ/4にするべきのように思うのですがどこか矛盾してますか?
コメントありがとうございます、
返信遅れてすいません。。
ご指摘の部分、間違ってましたね…。
正しくはエネルギー図はQ/4で、
Q/4=317+(-180/2)=227
Q=908
が正しかったです。
時間が取れるときに訂正しておきます!
現在丁度この熱化学方程式とエネルギー図を勉強している者です。
学習する上でこのような大変わかりやすいサイトを見つけることができ有難いです。
一つ質問があります。
演習問題③の四つ目の式でQを求める問題ですが、NH3の係数が4なので、エネルギー図に
化合物から伸びる下↓の反応熱はQ/4ではないのですか?
そうするとQ=908kJになると思うのですが。
お手数ですが教えていただけますでしょうか。よろしくお願いいたします。
嬉しいコメントありがとうございます!
そうですね、その部分間違えていました。。
訂正しておきます、ご指摘ありがとうございます!