今回は原子量・分子量・式量の解説です。
原子量・分子量・式量は一番基礎的な内容ながら、
そのあとの勉強のためにもかなり重要な概念です。
これらの理解が曖昧なせいで、
多くの高校生が「物質量(mol)」で苦戦してしまうのです。
ここでは原子量などの意味を定義から丁寧に解説します。
ここの内容をきっちりと理解しておくことで、
原子量などの理解が単に深まるだけでなく、
今後のモル計算などの理解にも役立ってくるでしょう。
短くすぐに読み切れる記事なので、
ぜひ最後まで読んでみてください。
原子の相対質量とは
原子の「相対質量」とは、
質量数12の炭素の質量が12だと仮定したときの、
他の元素の相対的な質量のことです。
原子はめちゃくちゃ小さくて、
1粒ずつの質量を考えるのはめちゃくちゃ大変です。
例えば炭素1粒の質量は1.9926×10-23です。
これを計算に使うのはあまりに大変ですね。
そこで炭素1粒の質量は12なんだと決めてしまって、
炭素の半分の質量なら6、倍の質量なら24と、
炭素基準に質量を考えるのが相対質量なのです。
例えば炭素Cと水素Hを1粒ずつ持ってくると、
炭素の方が12倍質量が大きいのでHの相対質量は1になります。
もし実際の質量で計算すると、
1.9926×10-23÷12=1.6735…×10-24
とめちゃくちゃややこしくなります。
水素や酸素が基準のときもありましたが、複雑な歴史的経緯で炭素が基準になっています。理由の一つには「同位体が少ない」というのがあります。なぜ同位体が少ない方がいいのかは、以下の記事を読むとわかると思います。
原子量とは
相対質量を考えることで、
1粒1粒の質量を考えやすくなりました。
しかし実際の状況では、
同じ元素で質量数が異なる同位体であれば、
同じ元素であっても相対質量が変化します。
ただ実際に化学物質を考えるときには、
原子1粒ずつで考えることはほとんどなく、
たくさんの粒が集まった状態で考えます。
そこでいちいち同位体ごとに質量を分けて考えていたら大変です。
そこで同じ元素の中で、
相対質量の平均を取ってしまったものが「原子量」です。
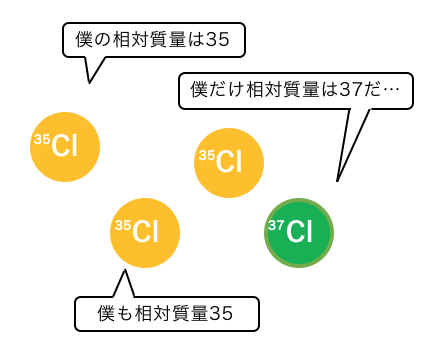
例えば塩素であれば、
自然界では4粒中3粒が35C、4粒中1粒が37Cです。
35Cが75%、37Cが25%あるということなので、
塩素の原子量は以下のとおりです。
\mathrm{ 35\times\frac{75}{100} + 37\times\frac{25}{100} = 35.5}
\]
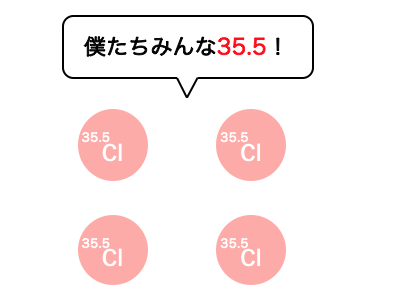
つまり塩素の同位体を意識せずに、
全ての原子が相対質量35.5であると考えればいいのです。
同位体ごとに相対質量を考えるより、
圧倒的に計算が楽になりそうですね。
このような理由で原子量というものが生まれました。
分子量・式量とは
「分子量」や「式量」は、
分子式や組成式、イオン式で表される物質の、
原子量の和のことです。
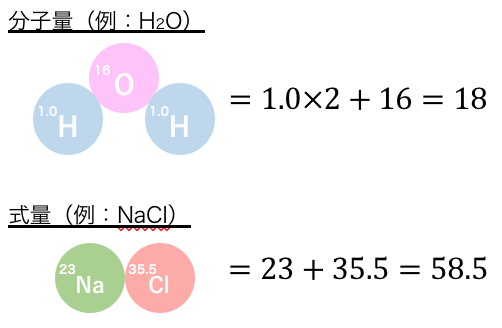
原子1粒の同位体を考慮した相対質量が原子量、
分子1粒の同位体を考慮した相対質量が分子量、
というようなイメージですね。
原子量を理解していれば、
これに関しては問題ないのではないでしょうか。
まとめ
今回は原子量・分子量・式量の説明でした。
相対質量は、
12Cを基準にした原子1粒の質量。
原子量・分子量・式量は、
同位体の影響も考慮してしまった場合の相対質量でした。
きちんと頭の中を整理しておきましょう。














コメントを書く