今回は電池の解説です。
高校化学の中でも、
電池を苦手とする受験生は非常に多いですね。
電池が苦手だと感じるのは、
そもそもその反応の仕組みを理解していないからです。
この記事では電池の仕組みを説明します。
電池の仕組みを理解してしまえば、
学校の試験や入試の問題はもちろんのこと、
全く見たことがない電池も簡単に解けるようになります。
また今回は、
学校では教えてくれない電池の秘密もお伝えします。
あなたの電池に対するもやもやも解消されることでしょう。
それでは説明していきます。
目次
電池の仕組み
「電池」とは、
酸化還元反応で放出されるエネルギーを、
電気エネルギーとして取り出す装置
です。
酸化還元反応は電子を欲しがる酸化剤と、
電子を投げたがる還元剤が近づくことによって、
電子を授受してWin-Winになる反応でした。
酸化還元反応が不安な人はまず以下をチェック!
それでは電池の仕組みを確認します。
通常の酸化還元反応は、
酸化剤と還元剤を接触させることで反応が起こります。
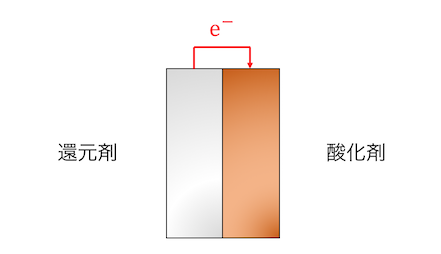
これを遠ざければ当然反応は止まります。
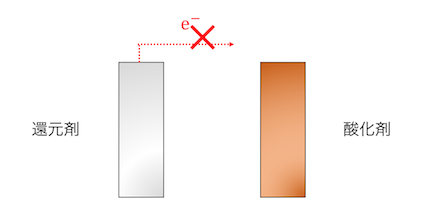
離れ離れになった酸化剤と還元剤を、
導線で結ぶことで反応させるのが電池の基本原理です。
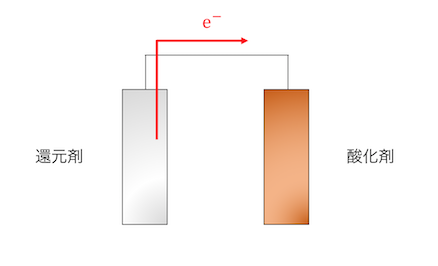
しかしただ結ぶだけでは、
電荷が偏ってしまうため反応が進みません。
導線で結ぶと同時に、
電解質によって電気的に結ぶことで、
酸化還元反応を起こすことができます。
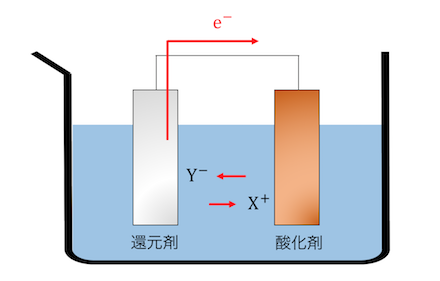
これが電池の基本原理です。
それでは「ダニエル電池」を具体例に、
実際の電池の働きを確認してみましょう。
ダニエル電池
「ダニエル電池」は以下のような電池です。
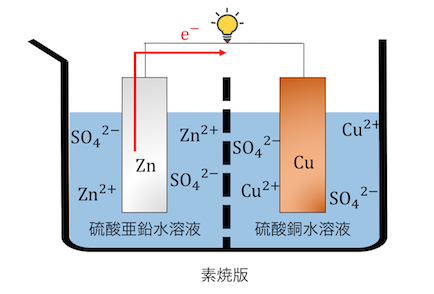
Znが還元剤、Cu2+が酸化剤として働く電池です。
実際にどのように酸化還元反応が起こるのかを、
順番に見ていきましょう。
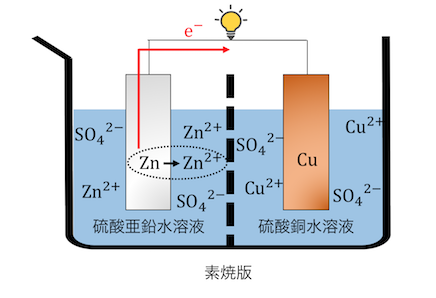
①Znが酸化反応を起こす
まずはZnが酸化反応を起こし、電子を導線に放出します。
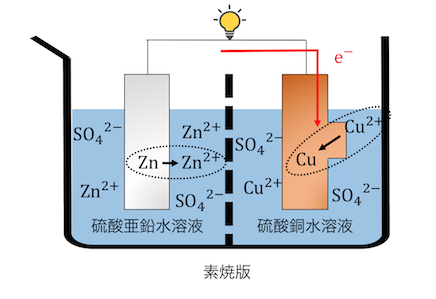
②Cu2+が還元反応を起こす
Znの酸化反応によって生じた電子が、
導線を通じてCuの電極にやってきます。
すると電解質中のCu2+が還元反応を起こします。
③SO42-が移動し電荷の偏りが解消される
①②が完了した時、
左側と右側で+-の差が出てしまっていますね。
これでは溶液間に「電場」が生じてしまいます。
これによってSO42-は左に動き出すのです。
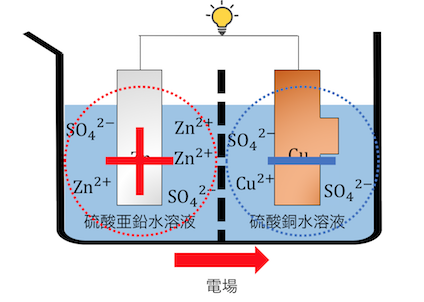
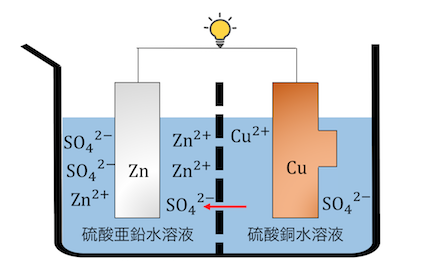
これによって電荷の釣り合いも保たれ、
酸化還元反応が完了しました。
「電荷を持ったものを動かす重力みたいなもの」です。より詳しくは物理の「電磁気学」で勉強します。まだ電場を習っていない場合は、「電荷が偏ってしまったから、それを解消するためにSO42-が移動した」と考えれば問題ありません。
ダニエル電池の注意点
ダニエル電池は素焼き板をうまく利用することで、
離れ離れに設置した酸化剤と還元剤を反応させる電池でした。
電池に関わる反応は、
陰極:Cu2++2e–→Cu
であり、還元剤がZn、酸化剤はCu2+です。
よって左側の溶液がZnSO4である必要はなく、
陰極はCuである必要はありません。
さらに、電池として長持ちさせたい場合は、
酸化剤と還元剤がたくさんあればいいですね。
つまり左のZnSO4水溶液よりも、
CuSO4水溶液の濃度を高くした方が長持ちします。
原理を考えれば当然ですね。
参考①:ボルタ電池
歴史上初めて作られた電池が「ボルタ電池」です。
ボルタ電池は以下のような仕組みで動作します。
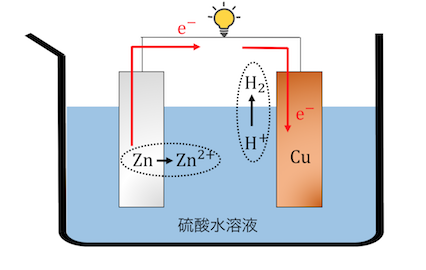
硫酸に亜鉛板と銅板を浸して導線で結ぶだけの、
非常に単純な電池ですね。
しかし、
作るのが非常に単純であるせいで、
「単純じゃない現象」がたくさん起きてしまいます。
どんなことが起こってしまうのか、
順番に確認していきましょう。
①亜鉛が直接硫酸と反応する
ボルタ電池は、
亜鉛が投げた電子が導線を伝って銅板にたどり着き、
それが水素イオンと結びついていきます。
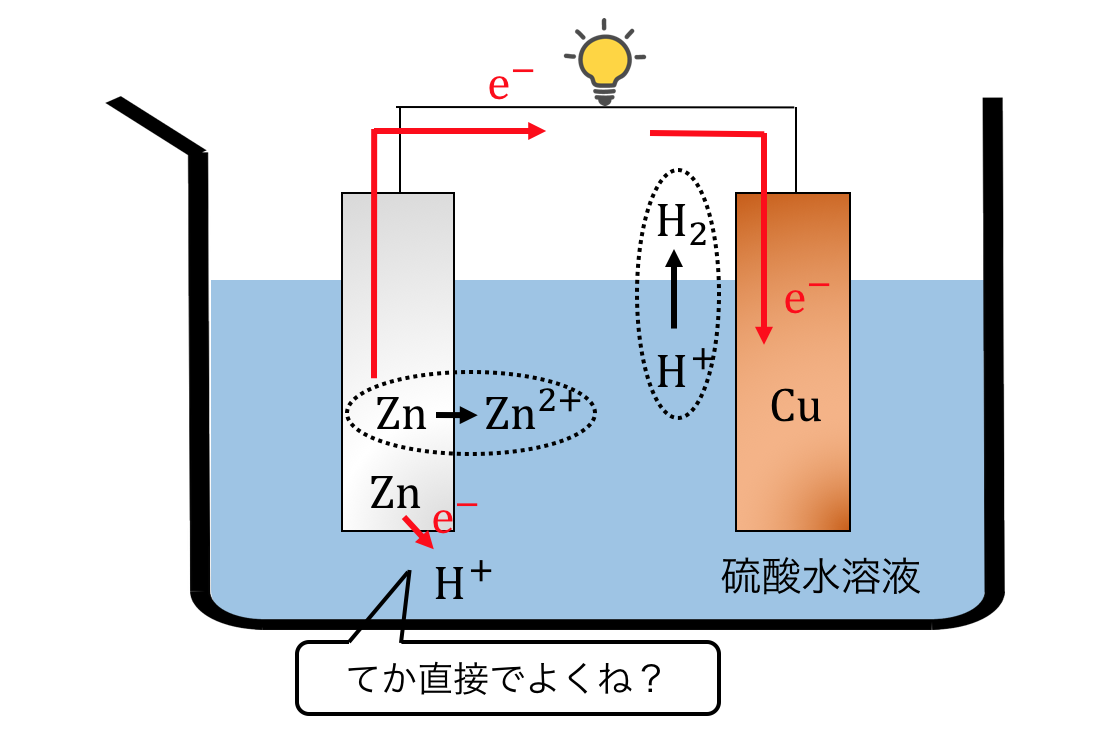
しかしよく考えれば、
亜鉛はそもそも硫酸と直接反応してしまいます。
つまり実際にボルタ電池を作ってみると、
亜鉛と銅の両方から水素が生じてしまいます。
言われてみれば当たり前ですよね。
②分極が起こる
「分極」という現象が起きて起電力が下がってしまいます。
これの原理を説明します。
ボルタ電池を動かしてしばらく経つと、
以下のような状態になります。
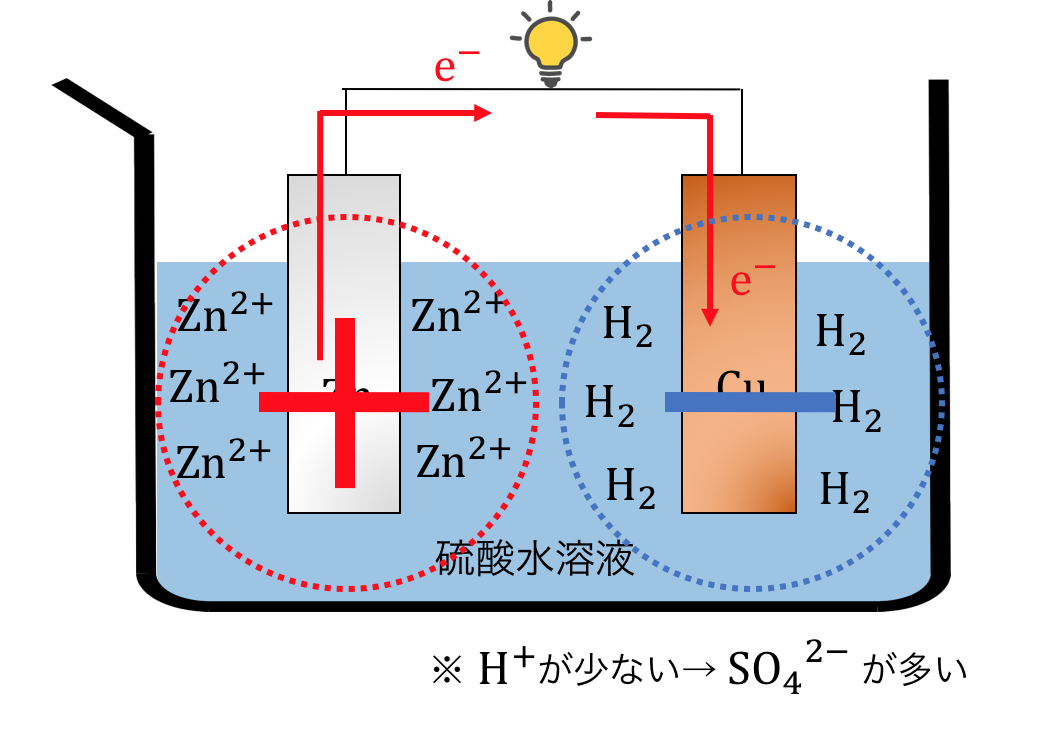
このように電荷が偏ったような現象を分極といいます。
すると、
2H++2e–⇄H2
の逆反応が進んでしまいます。
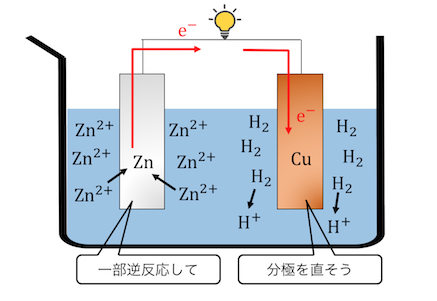
これによって起電力が下がってしまうのです。
③分極を防ぐために減極剤が必要
起電力が下がっては困ります。
そこでボルタ電池に過酸化水素水や二クロム酸カリウムなどの酸化剤を入れることで、
分極を防ぐことができます。
このような酸化剤のことを「減極剤」といいます。
ボルタ電池の正極では水素イオンが酸化剤になっていますが、
減極剤を加えるとその立場が入れ替わります。
水素イオンよりも減極剤の方が酸化力が圧倒的に高く、
分極による起電力の低下を抑えます。
しかしある意味ではボルタ電池とは別物になってしまいますね。
ボルタ電池まとめ
このようにボルタ電池は実は複雑です。
疑問を持つ受験生のために説明しましたが、
入試レベルでは全く必要のない知識です。
あくまで参考程度に考えておいてください。
参考②:さまざまな電池
[TBD]
まとめ
今回は電池の解説をしました。
自発的に起こる酸化還元反応を利用し、
電気エネルギーを取り出そうとするのが電池の本質でした。
その役割を助けてくれたのが、
酸化剤と還元剤を電気的につなぐ電解質です。
ただ「ダニエル電池」や「ボルタ電池」を見てわかるように、
実際に電池を作るためには様々な工夫がなされているのですね。














ダニエル電池の酸化剤、還元剤の表記
Znが酸化剤、Cu2+が還元剤として働く電池です。
→Znが還元剤、Cu2+が酸化剤として働く電池です。
ではないでしょうか?
あ、ほんとですね。
直しておきます、ご指摘ありがとうございます!
初めまして。初歩的な質問、失礼します。
参考①のボルタ電池について
なぜ亜鉛と硫酸が直接反応するのか教えて頂きたいです。
素朴に「硫酸に亜鉛をいれる」というのを考えてみてください。イオン化傾向がH以上の金属は、
Zn + H2SO4 → ZnSO4 + H2
という反応が起こって溶けますよね。
たとえ電池であったもこの反応が起こってしまうよ、というのが参考①です。もちろん導線を伝って酸化還元反応が起こって電池になる反応も起これば、直接金属が溶ける反応も同時に起こってしまうよ、ということになります。