沸点上昇・凝固点降下の解説です。
なんとなく溶液の分野というだけで、
苦手意識を持っている人が多いのではないでしょうか。
でも沸点上昇・凝固点降下は、
実はめちゃくちゃ簡単な分野です。
ここでミスってしまうのはもったいない。
この記事では仕組みから本質的に説明します。
ここの内容を理解しておけば、
沸点上昇・凝固点降下はもう忘れなくなります。
仕組みから理解すると、
忘れたくても忘れられなくなるのです。
ぜひ最後まで読んでみてください。
沸点上昇・凝固点降下とは
「沸点上昇」とは、
溶液に溶質を溶かすと沸点が上がる現象のことです。
同様に「凝固点降下」とは、
溶液に溶質を溶かすと凝固店が下がる現象のことです。
「上がったり下がったり、どっちなんだー!」
と思う人もいるかもしれませんが、
仕組みに注目すればこれは当然のことなんです。
では仕組みを見ていきましょう。
「邪魔者」のせいで沸点が上昇
液体は常に「気液平衡」の状態にあるのでした。
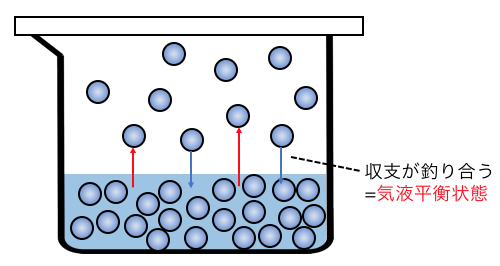
これに関しては以下の記事で解説しているので、
そちらをごらんください。
それではこのように気液平衡状態の水に、
例えば砂糖を溶かしたらどうなるでしょうか。
今まで自由に蒸発できていた水分子が、
砂糖という「邪魔者」によって蒸発を阻止されてしまいます。
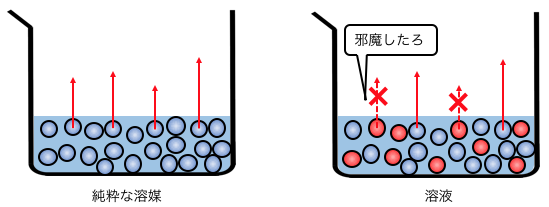
蒸発する力が弱まるのだから、
蒸気圧は小さくなりますよね。
これが「蒸気圧降下」です。
以下の蒸気圧曲線を見れば、
蒸気圧降下=沸点上昇だとわかりますね。
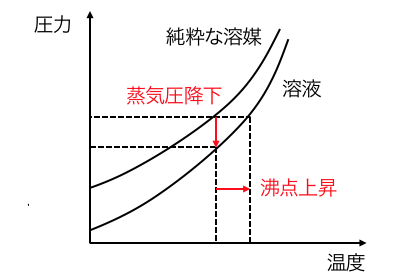
結局のところ、溶質という邪魔者のせいで、
沸騰に余計エネルギーが必要になるのが沸点上昇なのです。
凝固点降下も仕組みは同じ
凝固点降下も同じ仕組みです。
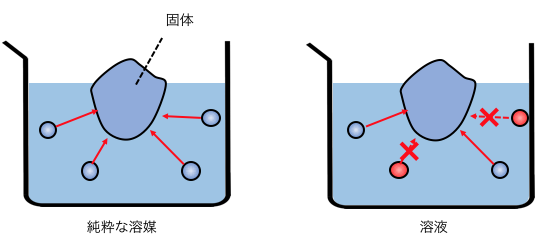
固体にぶつかる水が溶質に阻止されるため、
凝固するのに余計低い温度にする必要があるのです。
沸点上昇も凝固点降下も同じ仕組みですね。
沸点上昇度・凝固点降下度の計算
それでは、
実際に沸点上昇や凝固点降下において、
どのくらい沸点・凝固点が変化するのか見てみましょう。
沸点の上昇度を\(\Delta t_{b}\)、凝固点の降下度を\(\Delta t_{f}\)とすると、
溶質の種類に関係なく質量モル濃度\(m\)を使って表せます。
\mathrm{ \Delta t_{b} } &= \mathrm{ k_{b} \cdot m }(k_{b}:モル沸点上昇)\\
\mathrm{ \Delta t_{f} } &= \mathrm{ k_{f} \cdot m }(k_{f}:モル凝固点降下)
\end{align*}
日本語に直すなら、
沸点上昇度は質量モル濃度に比例する
となりますね。
その比例定数をモル沸点上昇といい、
溶媒の種類によって決まります。
普段はモル濃度を使うことが多いですが、
今回は「質量モル濃度」であることに気をつけましょう。
質量モル濃度については以下もチェックしておいてください。
沸点上昇の仕組みからもわかるように、沸点上昇度は溶媒の粒の数と溶質の粒の数の比で決まります。だから「溶質/溶媒」で定義された質量モル濃度が都合がいいのです。
計算の注意点
沸点上昇度や凝固点降下度は、
溶質の粒の数によって決まるのでした。
もし溶質が電解質で、
溶液中で電離してしまう場合は、
「邪魔者」が増えてしまいます。
よって溶質が電解質の場合は、
電離して粒が増えるのを考慮しないといけません。
仕組みを理解していれば、
「まあそうなりそうだな」と感じますね。
同じ理由で、
仮に溶質が「会合」するような場合は、
粒が減ることで温度変化も小さくなります。
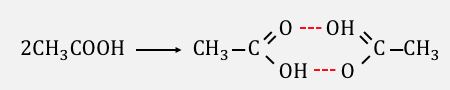
このような場合は、
「見かけの質量モル濃度」を考える必要があるので、
計算の際には注意しておきましょう。
練習問題
今回は理論の説明ばかりで計算をしていないので、
少しだけ練習問題を用意しておきます。
ぜひ自分で頭を使いながら解いてみてください。
(1)モル凝固点降下(\(k_{f}\))は何K・kg/molか。
(2)水100gにNaClを0.025mol溶かしたときの凝固点は何℃か。
(1)スクロースの質量モル濃度は、
\[
\mathrm{ \frac{25.7g\times \frac{1mol}{342g}}{500g\times \frac{1kg}{1000g}} ≒ 0.150mol/kg}
\]よって凝固点降下の公式から、
\begin{align*}
\mathrm{\Delta t_{f}} &= \mathrm{ k_{f}\cdot m } \\
\mathrm{0.279} &= \mathrm{ k_{f} \cdot 0.15 } \\
\mathrm{k_{f}} &= \mathrm{ 1.86K・kg/mol }
\end{align*}
(2)NaClの質量モル濃度は、
\[
\mathrm{ \frac{0.025mol}{100g\times \frac{1kg}{1000g}} = 0.25mol/kg}
\]ここで、NaClの電離に注意すると、粒子の総質量モル濃度は、
\[
\mathrm{ 0.25 \times 2 = 0.50mol/kg}
\]よって、
\[
\Delta t_{f} = 1.86\times 0.50 = 0.93K
\]純水の凝固点は0℃だから溶液の凝固点は-0.93℃。
まとめ
今回は沸点上昇、凝固点降下の説明でした。
溶媒に溶質という「邪魔者」が入ることで、
気体になったり固体になったりするのが邪魔され、
沸点や凝固点が変化するのでしたね。
そして温度変化は質量モル濃度に比例し、
\mathrm{ \Delta t_{b} } &= \mathrm{ k_{b} \cdot m }(k_{b}:モル沸点上昇)\\
\mathrm{ \Delta t_{f} } &= \mathrm{ k_{f} \cdot m }(k_{f}:モル凝固点降下)
\end{align*}
で表されるのでした。
ぜひ練習問題も自力で解いてみてください。














コメントを書く