塩の加水分解は授業では軽く扱われ、
意外ときちんと理解していない人が多いです。
そのくせpH計算は少し複雑で、
苦手に思っている人も多いでしょう。
塩の加水分解が苦手になってしまう理由は、
水溶液中の様子がイメージできていなく、
さらに計算の「型」が分かっていないからです。
ここでは塩の加水分解を本質的に説明します。
この記事を読むことで、
塩の加水分解が明確にイメージできるようになり、
加水分解への苦手意識が一掃されるでしょう。
ぜひ読み飛ばさずに、
最後まで読んでみてください。
塩の加水分解とは
この記事を読んでいるあなたは、
もうすでに中和滴定は知っているでしょう。
中和滴定のときに、
強酸+弱塩基だと中和点が酸性に、
弱酸+強塩基だと中和点が塩基性になったのを覚えていますか?
もし中和滴定が曖昧であれば、
先に以下を復習しておきましょう。
「強い方にpHが引っ張られる」
と感覚で理解していたかもしれませんが、
実はこれこそが「塩の加水分解」の結果なのです。
具体例として酢酸ナトリウムを考えてみましょう。
酢酸ナトリウムは塩ですから、
水に溶かすことで完全電離します。
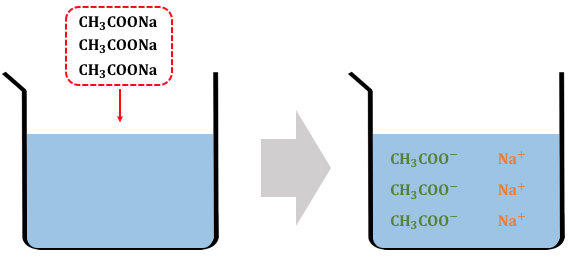
しかし酢酸イオンに目を向けると、
以下のような平衡状態になっているはずですよね。
\[
\mathrm{ CH_{3}COOH⇆CH_{3}COO^{-}+H^{+} }
\]
つまり完全電離しただけだと、
酢酸的には居心地が悪いわけです。
だからどうにか平衡を保つために、
以下のように水からH+を奪います。
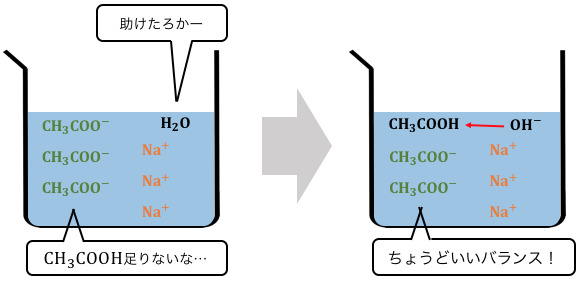
このように「水」を「加」えて平衡になるのが、
塩の加水分解なのです。
そしてその副産物として、
今回で言えばOH–が現れました。
「強塩基のせいで塩基性になる」というより、
「弱酸のせいでOH–が出て、結果塩基性になる」
という雰囲気ですね。
もちろんこれは強酸+強塩基の塩でも同じです。
塩の加水分解のpH計算方法
先ほどの酢酸ナトリウムの例で言えば、
塩の加水分解は以下のような反応でした。
\mathrm{ CH_{3}COO^{-} + H_{2}O ⇆ CH_{3}COOH + OH^{-} }
\]
今回の目標は、
この加水分解によるpHの値を求めることです。
中和滴定ではなんとなく覚えていた中和点を、
きっちり求められるというのは楽しいですね。
それでは見ていきましょう。
酢酸ナトリウムのpH計算
さてそれではpHを考えていきます。
塩の加水分解のpHの求め方は、
一度やり方を見ておかないと自分で思いつくことは不可能です。
少し集中してみていきましょう。
まずは式をもう一度書きます。
\mathrm{ CH_{3}COO^{-} + H_{2}O ⇆ CH_{3}COOH + OH^{-} }
\]
平衡定数の定義通り考えれば、
\[
\mathrm{ K=\frac{[CH_{3}COOH][OH^{-}]}{[CH_{3}COO^{-}][H_{2}O]} }
\]
そして初めに電離定数を考えたときと同じように、
\[
\mathrm{ K_{h}=K[H_{2}O]=\frac{[CH_{3}COOH][OH^{-}]}{[CH_{3}COO^{-}]} }
\]
としましょう(水を無視している理由がわからない人は上のリンクを踏んでください)。
この電離定数さえわかれば、
pHを計算できそうです。
今、当然酢酸の電離平衡も成り立っていますから、
同時に以下の式も成り立っています。
\[
\mathrm{ K_{a}=\frac{[CH_{3}COO^{-}][H^{+}]}{[CH_{3}COOH]} }
\]
ここからが達人技。
電離平衡の2つの式を掛け合わせてみます。
\begin{align*}
\mathrm{ K_{h} } & \times \mathrm{ K_{a} } \\
&= \mathrm{\frac{[CH_{3}COOH][OH^{-}]}{[CH_{3}COO^{-}]} \times \frac{[CH_{3}COO^{-}][H^{+}]}{[CH_{3}COOH]}} \\
&= \mathrm{ [H^{+}][OH^{-}] } \\
&= \mathrm{ K_{w} }
\end{align*}
なんとうまいこといろいろ約分されて、
Ka、Kh、Kwだけの式になりました。
普通KaとKwは与えられますから、
Khを求めることができそうですね。
ここまでくれば、
ただの電離定数の時同様に[OH–]が求まります。
(塩の濃度C[mol/L])
\[\mathrm{ [OH^{-}] = \sqrt{CK_{h}} }\]
参考:塩の加水分解の真実
KhがKaとKwで表せるなんて、
奇跡のように感じますね。
しかし実はこれは当たり前のことです。
ここからは必須の内容ではないので、
リラックスして読んでみてください。
塩の加水分解の説明の前に、
「水溶液中のイオンの振る舞い」の復習です。
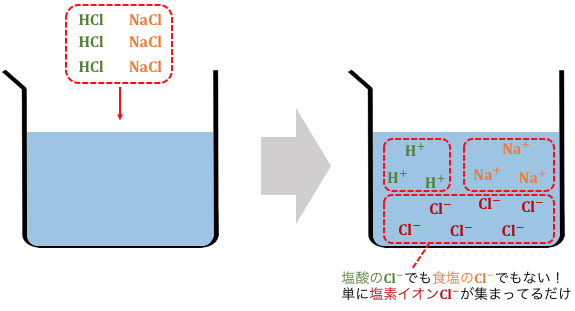
このように、
一度電離してしまえば、
同じイオンに区別はないのでしたね。
溶液中では
「酢酸出身の水素」や「水出身の水素」などはないわけです。
これを理解したところで、
まずは酢酸ナトリウムを完全電離させます。
このとき当然水も同時に電離しているはずですね。
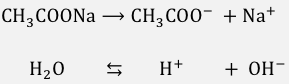
このように、
CH3COO–、Na+、H+、OH–
がふわふわ浮いています。
しかし先ほど考えた通り、
酢酸の平衡も成り立たないとおかしいわけですよね。
となると、
さらに以下のような反応式がかけます。
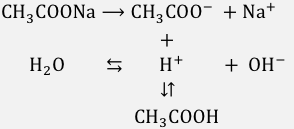
このように、
同じH+を使って2つの平衡が成り立っています。
以上から加水分解反応は、
水が電離して、酢酸が電離する逆反応が進む、
という二段階の反応であると考えられます。
だから加水分解の電離定数は、
水の電離(Kw)と酢酸の逆反応(1/Ka)をかけて、
Kh=Kw/Kaとなるのです。
本当は、ただ水や酢酸が、
自分の平衡のバランスを取っているというだけで、
それを外から観察したら「加水分解」に見えているだけということになります。
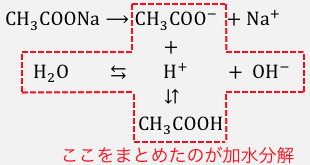
水溶液中のイオンのイメージが湧かないと、
少し難しかったかもしれませんね。
(逆に混乱したらすいません 笑)
あくまで補足程度に押さえておいてください。
あえてここには図を描きませんので、自分で描いてみてください。もしコメントなどで要望があれば追記するかもしれません。
まとめ
今回は塩の加水分解の解説でした。
化学平衡の意味さえ分かっていれば、
意外と単純な現象だったのですね。
実践的には、
\begin{align*}
\mathrm{ K_{h} } & \times \mathrm{ K_{a} } \\
&= \mathrm{\frac{[CH_{3}COOH][OH^{-}]}{[CH_{3}COO^{-}]} \times \frac{[CH_{3}COO^{-}][H^{+}]}{[CH_{3}COOH]}} \\
&= \mathrm{ [H^{+}][OH^{-}] } \\
&= \mathrm{ K_{w} }
\end{align*}
の式変形ができるかどうかが大きな分かれ目になります。
一度自分でも確かめてみてください。
【合わせてチェック】
化学平衡は正反応と逆反応のせめぎ合い。
ではせめぎ合いの「原因」は何なんでしょう。
以下で詳しく解説しているので、
ぜひチェックしてみてください。













コメントを書く