中和反応は比較的慣れ親しんだ反応で、
なんとなく理解した気になっている受験生が多いです。
しかし、
「中和反応ってなんで起こるの?」
「HClaqをNH3で中和してもなんで酸性のままなの?」
なんて聞かれてみると意外と「なんで?」と思いませんか?
このように、
実は中和反応をしっかり理解できている受験生は少ないのです。
この記事では中和反応の解説をします。
この記事を読む事で、
迷うことなく中和反応式を作れるようになり、
中和滴定の問題もスラスラ解けるようになります。
記事の後半にはセンター試験でも頻出の、
塩の液性の解説もあるのでぜひ最後まで読んでくださいね。
目次
中和反応の仕組み
中和反応をイオン反応式で書けば、
となります。
中和反応の本質はこのイオン反応式です。
それでは中和反応はなぜ起こるのでしょうか?
例えば1mol/Lの塩酸HClと水酸化ナトリウムNaOHを、
それぞれ1Lずつ混ぜた場合を考えてみましょう。
溶液を混ぜることで溶液の量が2倍になっているので、
混ぜた後のHClとNaOHの濃度は0.5mol/Lです。
これが電離することで、
水素イオン濃度[H+]=0.5mol/L、
水酸化物イオン濃度[OH–]=0.5mol/L、
となります。
さてここで水の電離について思い出してみます。
水は電離平衡状態にあるんでしたね。
しかもこのとき、
Kw=[H+][OH–]=10-14(25℃)
が成り立つのでした。
10-14は相当小さいですね。
つまり今回のように0.5mol/LものH+やOH–が現れれば、
ルシャトリエの原理からどんどん水にならざるをえません。
こうして結局
となる中和反応が起こるのです。
中和反応の作り方
それでは中和反応を実際に作ってみましょう。
今回は以下の問題を例に、
中和反応の反応式を立てていきます。
(1)HClaqとCa(OH)2aq(多量)
(2)CO2(気体)とNaOHaq(多量)
(3)CaO(固体)とHClaq(多量)
(1)HClaqとCa(OH)2aq(多量)
先ほど説明した通り中和反応のイオン反応式は、
でした。
ただ今回はCa(OH)2が一度に2つOH–を出すので、
あとは両辺をCl–とCa2+で調節して、
(2)CO2(気体)とNaOHaq(多量)
CO2をNaOH水溶液に入れると、
まずはCO2が水に溶ける反応がおきます。
そして次に発生したH2CO3と中和反応を起こします。
(この中和反応式は(1)と同様。)
前者の反応は平衡反応ですが、
後者の反応が起こることで平衡が右に偏り、
結局全て反応し切ります。
よって2式を足し算すれば、
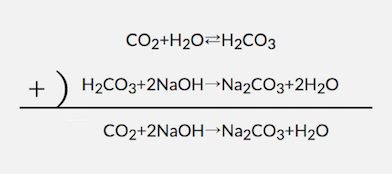
(3)CaO(固体)とHClaq(多量)
CaOをHCl水溶液に入れると、
まずはCaOが水に溶ける反応がおきます。
そして次に発生したCa(OH)2と中和反応を起こします。
これら2式を足し算すれば、
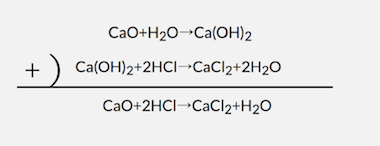
(例)Al2O3とHClaq
Al2O3は水に溶けないが形式的に水を足して、
Al2O3+3H2O→2Al(OH)3
以上から、
Al2O3+6HCl→2AlCl3+3H2O
酸・塩基の強さと塩の性質
ここまで中和反応の仕組みをみてきました。
しかし本当に中和反応を理解するためには、
酸と塩基の強弱を考えていく必要があります。
酸・塩基の強弱について理解することで、
塩の性質がよく理解できると思います。
酸・塩基の強弱
酸・塩基のうち、
ほぼ完全に電離してしまうのが強酸・強塩基、
一部だけが電離するのが弱酸・弱塩基です。
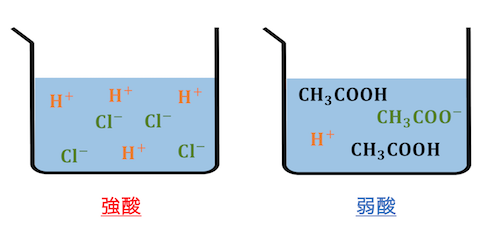
酸・塩基の強弱は、
中和反応自体には特に影響がありません。
なぜなら次の仕組みで反応が進むからです。
強酸と弱塩基で考えてみましょう。
十分な量の強酸に弱塩基を混ぜた瞬間、
強酸は完全に電離してH+を出していて、
弱塩基は一部だけ電離してOH–を出しています。
まずはこれらが全て中和反応を起こします。
すると弱塩基は全く電離していないような状態になり、
また一部だけが電離してOH–を出します。
これが繰り返されることで結局すべての弱塩基が中和されます。
実際のところ、
酸・塩基の強弱が重要になってくるのは、
中和後の塩の性質を考えるときです。
塩の性質
先ほどの例と同じく強酸と弱塩基の塩を考えます。
例えばHClとNH3の塩であるNH4Clを考えますね。
同じ量のHClとNH3を混ぜ合わせたとき、
完璧に中和反応が起こって以下の状態になります。
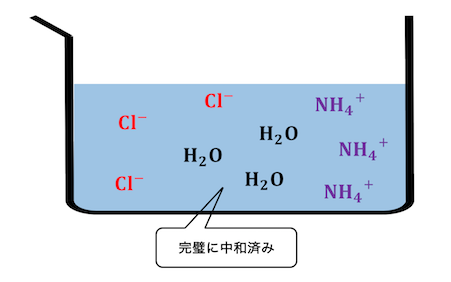
しかしNH4+は本当は以下の関係にありました。
電離しすぎも電離しなさすぎも嫌な状態です。
今、溶液中にはNH4+ばかりなので、
バランスを取るために以下のような反応が起きます。
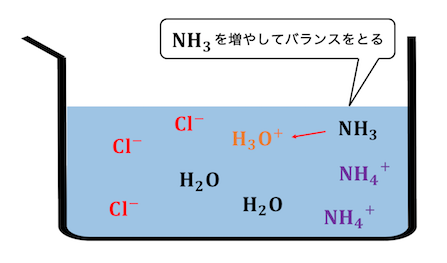
このような反応を「加水分解」といいます。
この反応によって、
強酸と弱塩基の中和反応でできた塩は、
溶液中で酸性になることがわかります。
同様に弱酸と強塩基の塩は塩基性です。
この原理によって、
「強い方の性質が塩の性質に残る」
という性質が生じるわけです。
原理から考えれば、「弱酸と弱塩基の塩の液性は予測できない」とわかります。実際にはそれぞれの電離平衡の兼ね合いで液性が決まります。
[Al(H2O)6]3++H2O⇄[Al(OH)(H2O)5]2++H3O+
という加水分解反応が起こるからです。
正塩・酸性塩・塩基性塩
完全に中和していても酸・塩基の強弱で、
性質が変わることがわかったと思います。
しかし以下のような塩では注意が必要です。

以上のうち、例えばNaHSO4は、
強酸と強塩基からできた塩でありながら、
以下の反応で酸性になります。
さらにNaH2PO4、NaHSO3は、
以下の反応と加水分解反応が同時に起こります。
HSO3–⇄H++SO32-
NaH2PO4、NaHSO3は、
加水分解よりもこちらの電離反応の方が多く起きて、
結果的に溶液は酸性になります。
最後にNaHCO3は、
以下の電離と加水分解が同時に起きて、
結果的に溶液は塩基性になります。
「酸性塩は酸性、塩基性塩は塩基性」というわけではなく、
個別に考えていかないといけないのですね。
塩と酸・塩基の反応
塩に酸や塩基を加えると、
場合によっては以下のような反応が起こります。
2NH4Cl+Ca(OH)2→CaCl2+H2O+NH3(弱塩基遊離)
このように、
弱酸と強塩基の塩に強酸を加えると弱酸が、
強酸と弱塩基の塩に強塩基を加えると弱塩基が、
出てくる反応を「弱酸・弱塩基遊離反応」といいます。
この原理などは以下の記事で詳しく説明しているので、
ぜひ目を通してみてください。
まとめ
盛りだくさんになってしまいましたが、
・中和がなぜ起こるのか
・反応式をどう作るのか
・塩の液性はどうなるのか
がきちんと理解できましたか?
これで他の受験生よりも一歩先に進めたと思います。
また今回の発展版である「中和滴定」についても、
以下の記事で解説しているので合わせてごらんください。














コメントを書く