「酸化還元反応がわからない」
「覚えることが多すぎる」
「覚えたつもりでもすぐ忘れてしまう」
あなたはこんな風に悩んでいませんか?
闇雲に知識やテクニックを暗記しても、
本当に「酸化還元反応を理解した!」という状態になるのは難しいです。
いつまで経っても知識が自分のものにならないのは、
酸化還元反応の仕組みを理解していないからです。
ここでは、酸化還元反応を心の底から理解するための、
反応の本質的な仕組みをお伝えしますね。
ここでお伝えする仕組みを理解することで、
初めての問題でも半反応式を立てられるようになり、
「酸化還元反応はもう勉強する必要なし!」という状態になります。
確信を持って問題を解けるようになり、
自信につながるでしょう。
反応の仕組みを無視して勉強しても、
結局テクニックの丸暗記になってしまって、
本質的な理解には結びつきません。
今まで丸暗記していた半反応式がサラサラ書け、
未知の問題に出会っても確信を持って解答できる方法についてお教えします。
目次
酸化還元反応とは
「酸化還元反応」は、物質が電子を欲しがることで起こる反応です。
言い換えれば、電子が欲しいなーと思っていた物質が、
電子いらないなーと思っていた物質と出会うことで、
お互いにWin-Winになるから起こる反応です。
そして物質がどれくらい電子を欲しいのかは、
「酸化数」からわかります。
酸化数が大きければ電子を奪いたくなり、
小さければ電子を捨てたくなるんでしたね。
たとえばマンガンMnが取りうる酸化数が+7から0までなのに対し、
過マンガン酸カリウムKMnO4内のMnの酸化数は7+。
かなり電子が不足しています。
めちゃくちゃ電子を欲しがっている状態です。
一方、シュウ酸(COOH)2のCの酸化数は+3で、
Cの最大の酸化数+4まで余裕があります。
電子がいらない状態ということです。
そして電子がめっちゃ欲しいKMnO4と
電子がいらない(COOH)2が出会うことで
酸化還元反応が起こります。
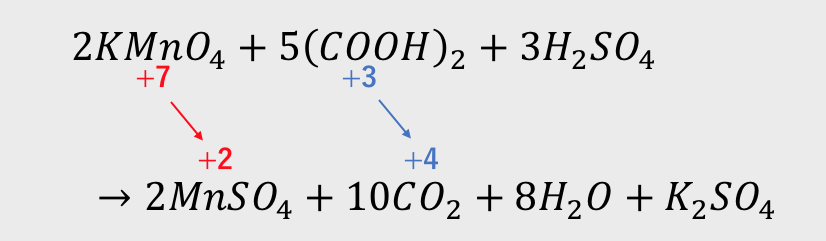
酸化還元反応とは、
・電子が欲しいから電子を奪う反応
・電子がいらないから電子を投げる反応
ということですね。
半反応式の作り方
酸化還元反応式を作るためには、
「半反応式」を作る必要があります。
半反応式とは、
酸化剤か還元剤の片方にだけ注目したときの
仮の反応式のことです。
酸化剤の反応を見るために半反応式を作り、
還元剤の反応を見るために半反応式を作り、
それを組み合わせれば酸化還元反応式になります。
そしてもちろん、
酸化還元反応式や半反応式は、
暗記するものではありません。
きちんと作り方を理解しておけば、
その場で反応式を作ることができます。
それでは作り方を見ていきましょう。
半反応式を作る4ステップ
教科書には大抵半反応式の表がありますね。
それを見て、
「え、これ、全部覚えるの…?」
と思ったのではないでしょうか。
しかし実際には、
半反応式は自分で作ることができます。
最初に何が何に変化するかさえ覚えておけば、
あとはその場で作れるんですね。
具体的には、半反応式は以下の「4ステップ」で作れます。
① 反応後の物質を書く
② 酸化数を調べて、電子の変化量を書く
③ 溶液中のイオンで全体の電荷を中性にする
④ H2Oで原子数を調節する
ここでは過マンガン酸イオンMnO4 –(硫酸酸性)を例に考えてみましょう。
①反応後の物質を書く
まずは反応物(今回でいうMnO4 –)が、
最終的に何に変化するかを書きます。
残念ながらここは暗記するところ。
酸化還元反応の唯一の暗記部分なので、
頑張って覚えましょう。
②酸化数を調べて、電子の変化量を書く
酸化数を調べることで、
電子がいくつ欲しい/いらないのかがわかります。
たとえば今回はMnの酸化数が+7から+2に変化しています。
つまり酸化数の差分を考えれば、
MnO4–→Mn2+ではMn原子が
電子を5つを受け取っていることがわかります。
電子を欲しがるから反応が起こるんだ!
というのがわかりやすいですね。
③溶液中のイオンで全体の電荷を中性にする
このように電子を受け取ることはわかりましたが、
現状、左辺の電荷の合計が-6、右辺の電荷の合計が+2です。
反応が起こるほど電荷が発生する、
ってのもおかしな話ですよね。
よって反応の前後で電荷が変化しないように、
溶液中のイオンで全体の電荷を調整する必要があります。
通常は水溶液中での反応を扱うことが多いため、
溶液が酸性であればH+、中性・塩基性ならOH–で調整します。
今回は硫酸酸性条件なので、
左辺に8H+を加えて電荷を調整します。
④H2Oで原子数を調節する
反応によってHやOの原子が生まれる、
というのもおかしな話です。
電荷調整にH+やOH–を用いたの同様、
原子数調整にH2Oを用いましょう。
右辺に4H2Oを加えることで原子数を調整できます。
以上で半反応式の完成です。
練習:シュウ酸の半反応式
以上では酸化剤MnO4–の半反応式を考えましたが、
練習も兼ねて還元剤(COOH)2の半反応式も作ってみましょう。
まずは反応後の物質を書きます。
次に酸化数を調べましょう。
酸化数変化は+3→+4だから、1原子のCに対して電子が1個。
シュウ酸にはCが2原子あるから電子を2個放出しています。
そしてシュウ酸は酸性なので、
両辺の電荷のズレをH+で調整。
最後にH2Oで帳尻を合わせます。
しかし今回はすでに帳尻が合っているのでこれで完成です。
酸化還元反応式の作り方
ここまでで半反応式の作り方を考えてきました。
ここからは半反応式を合わせて、
酸化還元反応式を完成させていきましょう。
酸化還元反応の作り方は以下の3ステップです。
① 酸化剤と還元剤の半反応式を作る
② 電子の数を合わせて辺々を足す
③ 省略していたイオンを元に戻す
それでは実際にこの流れを確かめていきます。
①酸化剤と還元剤の半反応式を作る
先ほど酸化剤MnO4–と還元剤(COOH)2の半反応式を作ったので、
この2つの酸化還元反応式を作っていきましょう。
まずは酸化剤と還元剤の半反応式を用意します。
(COOH)2 → 2CO2 + 2H+ + 2e–
②電子の数を合わせて辺々を足す
次にこれらの式を1つのイオン反応式にしていきます。
はじめに説明した通り酸化還元反応は、
電子の受け渡しをしてWin-Winになる反応
でしたね。
つまり酸化剤が受けとる電子の数と、
還元剤が捨てる電子の数が一致していなければいけません。
今回は2つのKMnO4に対して、
5つの(COOH)2を反応させれば電子がぴったりです。
ということでまずはKMnO4の式の全体を2倍、
(COOH)2の式の全体を5倍にします。
5(COOH)2 → 10CO2 + 10H+ + 10e–
これを足し合わせれば、
これで目的のイオン反応式が手に入りました。
③省略していたイオンを元に戻す
最後に酸化還元反応式を完成させましょう。
これまで何気なくMnO4–としてきましたが、
実際には過マンガン酸カリウムKMnO4を酸化剤としています。
さらに今回は硫酸酸性条件だから、
H+も実は硫酸H2SO4から提供されたものです。
以上を考慮して酸化還元反応式を完成させていきましょう。
左辺の2MnO4–を2KMnO4に、
6H+を3H2SO4に加える分、
右辺にも2K+と3SO42-を加えます。
これによって酸化還元反応式の完成です。
少し大変でしたが、
これだけ複雑な式を自分の力で作れるのは面白いですね。
練習問題

頭で理解するだけでなく、
実際に手を動かしてみるのも大切です。
いくつか問題を用意して置くので、ぜひ試してみてください。
問題
(1)銅
(2)酸性条件における過酸化水素(還元剤として)
(3)酸性条件における二クロム酸イオン
(4)熱濃硫酸(硫酸イオン)
(5)中性・塩基性条件における過酸化水素
(6)中性・塩基性条件における過マンガン酸カリウム
以下の酸化還元反応の反応式を作りなさい。
(1)硫酸酸性下で過酸化水素水に
二クロム酸カリウムを加えた。
(2)銅を熱濃硫酸で溶かした。
(3)中性・塩基性条件でヨウ化カリウムに
過マンガン酸カリウムを加えた。
解答・解説
(1)Cu → Cu2+ + 2e–
(2)H2O2 → O2 + 2H+ + 2e–
(3)Cr2O72- + 14H+ + 6e– → 2Cr3+ + 7H2O
(4)SO42- + 4H+ + 2e– → SO2 + 2H2O
(H2SO4 + 2H+ + 2e– → SO2 + 2H2O)
(5)H2O2 + 2e– → 2OH–
(6)MnO4– + 2H2O + 3e– → MnO2 + 4OH–
(1)反応後の物質を書くと、Cu → Cu2+
酸化数が0→+2に増えているので、
Cu → Cu2+ + 2e–
この時点で式が成り立っているのでこれで完成。
(2)反応後の物質を書くと、H2O2 → O2
H2O2内の2つの酸素原子について、
酸化数がそれぞれ-1→0に減っているから、
H2O2 → O2 + 2e–
酸性条件なので、電荷が一致するようにH+で調節すると、
H2O2 → O2 + 2H+ + 2e–
この時点で式が成り立っているのでこれで完成。
(3)反応後の物質を書くと、Cr2O72- → 2Cr3+
Cr2O72-内の2つのクロム原子について、
酸化数がそれぞれ+6→+3に減っているので、
Cr2O72- + 6e– → 2Cr3+
酸性条件なので、電荷が一致するようにH+で調節すると、
Cr2O72- + 14H+ + 6e– → 2Cr3+
最後に水で原子数を調節して、
Cr2O72- + 14H+ + 6e– → 2Cr3+ + 7H2O
(4)反応後の物質を書くと、SO42- → SO2
酸化数が+6→+4に減っているので、
SO42-2e– → SO2
酸性条件なので、電荷が一致するようにH+で調節すると、
SO42- + 4H+ + 2e– → SO2
最後に水で原子数を調節して、
SO42- + 4H+ + 2e– → SO2 + 2H2O
(5)反応後の物質を書くと、H2O2 → 2OH–
(中性・塩基性条件に注意!)
酸化数が-1→-2に減っているので、
H2O2 + 2e– → 2OH–
もしくは(2)の両辺にOH–を足すことでも作れます。
(6)反応後の物質を書くと、MnO4– → MnO2
(中性・塩基性条件に注意!)
酸化数が+7→+4に減っているので、
MnO4– + 3e– → MnO2
中性・塩基性条件なので、電荷が一致するようにOH–で調節すると、
MnO4– + 3e– → MnO2 + 4OH–
最後に水で原子数を調節して、
MnO4– + 2H2O + 3e– → MnO2 + 4OH–
(1)K2Cr2O7 + 3H2O2 + 4H2SO4 → 2Cr2(SO4)3 + K2SO4 + 3O2 + 7H2O
(2)Cu + 2H2SO4 → CuSO4 + 2H2O + SO2
(3)2KMnO4 + 6KI + 4H2O → 2MnO2 + 3I2 + 8KOH
(1)二クロム酸カリウムは1人で6つの電子が欲しい。
過酸化水素は1人で2つの電子をあげられる。
つまり、K2Cr2O7 + 3H2O2を考えればいい。
前半の問題の(2)(3)を使えば、
Cr2O72- + 3H2O2 + 8H+ → 2Cr23+ + 3O2 + 7H2O
硫酸酸性下より、左辺の8H+は4H2SO4を指していることに注意すると、
K2Cr2O7 + 3H2O2 + 4H2SO4 → 2Cr2(SO4)3 + K2SO4 + 3O2 + 7H2O
(2)熱濃硫酸は1人で2つの電子が欲しい。
銅は1人で2つの電子をあげられる。
つまり、Cu + H2SO4を考えればいい。
前半の問題の(1)(4)を使えば、
Cu + H2SO4 + 2H+ → CuSO4 + 2H2O + SO2
硫酸酸性下より、左辺の2H+はH2SO4を指していることに注意すると、
Cu + 2H2SO4 → CuSO4 + 2H2O + SO2
(3)まずヨウ素イオンの半反応式は2I–→I2+2e–
過マンガン酸カリウムは1人で3つの電子が欲しい。
ヨウ化カリウムは2人で2つの電子をあげられる。
つまり、\( \mathrm{ 2KMnO_{4} + 6KI }\)を考えればいい。
前半の問題の(6)を使えば、
2KMnO4 + 6KI + 4H2O → 2MnO2 + 3I2 + 8KOH
まとめ

今回は酸化還元反応の仕組みと、
酸化還元反応式の作り方を説明しました。
酸化剤が電子を欲しがるからこそ、
還元剤が電子を捨てたがるからこそ、
酸化還元反応が起こるということが理解できたと思います。
また半反応式や酸化還元反応式は、
以下の流れで作ることができましたね。
① 反応後の物質を書く
② 酸化数を調べて、電子の変化量を書く
③ 溶液中のイオンで全体の電荷を中性にする
④ H2Oで原子数を調節する
酸化還元反応式を作る3ステップ
① 酸化剤と還元剤の半反応式を作る
② 電子の数を合わせて辺々を足す
③ 省略していたイオンを元に戻す
あとは多少の演習をすれば、
酸化還元反応のどんな問題が出されても
詰まらずに解けるでしょう。
ぜひ酸化還元反応の問題を解くときには、
いつもこの記事を思い出してみてください。














いつもわかりやすい記事をありがとうございます。
「③省略していたイオンを元に戻す」の完成した酸化還元反応式についてですが、
2KMnO4 + 5(COOH)2 + 6H2SO4 → 2MnSO4 + K2SO4 + 10CO2 + 8H2O
とありますが、左辺の硫酸の係数は「3」だと思われますがいかがでしょうか。ご確認くださいますようお願いいたします。
コメントありがとうございます!
そうですね、係数は3が正しいです。
丁寧にご指摘いただきありがとうございますm(__)m
解答・解説の
(2)反応後の物質を書くと、H2O2 → O2
H2O2内の2つの酸素原子について、
酸化数がそれぞれ-1→0に減っているから、
H2O2 → 2H2O + 2e– →2H2O × O2〇
酸性条件なので、電荷が一致するようにH+で調節すると、
H2O2 → O2 + 2H+ + 2e–
この時点で式が成り立っているのでこれで完成。
と思われます。ご確認のほど、よろしくお願いいたします。
こちらも明らかなミスですね…。
すいません、先ほどのと合わせて
すぐに訂正しておきますねー。
②酸化数を調べて、電子の変化量を書く
について質問があります。
なぜ酸化数の変化が電子の変化量になるのでしょう?
「電子を欲しがるから~」と書かれていますが、
陰イオン→陽イオンの変化なので電子を受け取っているようには見えません。
機械的で分かりにくいので、
理論的(現象的?)に説明をしてもらえたら嬉しいです。
それに関しては酸化数の記事を読んでもらえればと思います。
http://www.jukenmemo.com/chemistry/theory/ox-number/
ここでも簡単に説明しておくと、
そもそも酸化数とは「電子の増減を表す指標」で、分子やイオン中の「原子」に定義されるものです。
たとえばMnO4-内のMnは、電気陰性度の大きいOに囲まれて7個電子を奪われているから酸化数+7です。
また、Mn2+はMnの状態から電子を2個捨てているから酸化数+2です。
つまりMn原子にだけ注目すれば、
電子7個が不足する状態から
電子2個が不足する状態へ変化した、
ということになります。
これはつまり電子を5個受け取った
ということですよね。
全体が陰イオンか陽イオンかは関係ありません。
より詳しくは酸化数の方も読んでみてください。