あなたは「酸化数の定義」を答えられますか?
「水素が+1、酸素が-2のやつ」
「分子全体では0になるやつ」
「H2O2は例外で酸素が-1になるやつ」
このような知識は思い浮かんでも、
「定義」はなかなか思いつかないのではないでしょうか。
なぜ酸化数の定義が思い浮かばないかというと、
学校の先生も教科書も定義を教えてくれないからです。
「酸化数が何者なのか」を知らずに、
正確に酸化数を求めることも、
酸化数を求める意味を理解することもできません。
この記事では、
酸化数の定義や求め方、その意味に至るまで、
わかりやすく丁寧に解説します。
酸化数に対する今までのモヤモヤが全て解決し、
もうテストで間違えることはなくなります。
酸化数の説明の後には、
その応用である酸化還元反応の説明もあるので、
ぜひ最後まで読んでみてくださいね。
酸化数の定義
酸化数の定義は、
なぜか学校では教えてくれません。
ここできっちり抑えておきましょう。
酸化数とは
酸化数を簡単に言うならば、
「どれだけ電子が多いか・少ないか」
です。
例えば水分子H2Oに注目してみましょう。
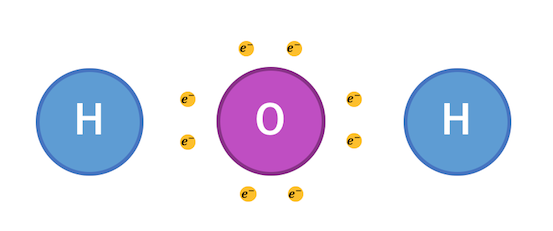
このように電子を共有して、
閉殻構造になることで安定しているのでした。
このとき実際には、
共有電子対は水素Hと酸素Oのちょうど真ん中にある訳ではありません。
より電気陰性度が大きい酸素Oが、
共有電子対を自分の近くに引き寄せています。
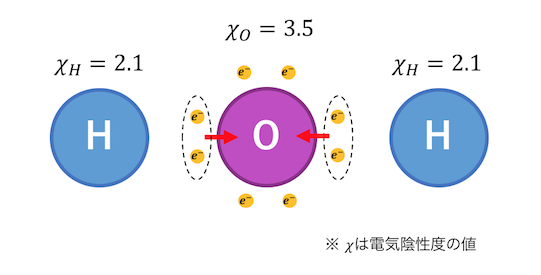
酸素Oは水素の電子まで引っ張って電子が増え、
水素Hは酸素に電子を取られて電子が減っています。
以上のように、
周りの原子からどれだけ電子を取ったか/取られたかこそが、
酸化数の定義です。
水H2Oの酸素Oの酸化数は-2、
水素Hの酸化数は+1だとわかりますね。
酸化数の正しい定義
酸化数の定義をより正確に書けば、
以下のようになります。
共有電子対を電気陰性度の大きい原子の方に移したときの、
単体の場合からの電荷の増減
もしくはこのようにも言い換えられます。
各元素のイオンの価数
H2O中のOの酸化数:-2
H2O2中のOの酸化数:-1
O2中のOの酸化数: 0
O2F2中のOの酸化数:+1
OF2中のOの酸化数:+2
となります。
酸化数の求め方のルール
酸化数の定義は本質的ではありますが、
毎回構造式を書くのは骨が折れます。
そこで酸化数を比較的簡単に求める、
ルールを紹介します。
酸化数の求め方
酸化数は以下のルールを使って求めます。
① 水素は+1、酸素は-2
② アルカリ金属は+1、2族元素は+2
③ ハロゲンは-1
④ 分子全体の酸化数の総和は0
イオン全体の酸化数の総和は価数
⑤ ①〜④が競合した場合は、
構造式を書いて定義から考える
①〜④は教科書で習ったものと同じですね。
これに加えて例外を覚えたり、
追加のルールを加えようとする場合がありますが、
①〜④でダメなら定義に戻るのが一番早いです。
それでは実際に酸化数を求めてみましょう。
練習問題
(1)CO2 (C)
(2)NaHSO4 (S)
(3)MnO4– (Mn)
(4)H2O2 (O)
(5)HClO (Cl)
一緒に解いてみましょう。
(1)CO2 (C)
①より酸素Oは-2、④より総和は0だから、
下の計算により炭素Cの酸化数は+4です。

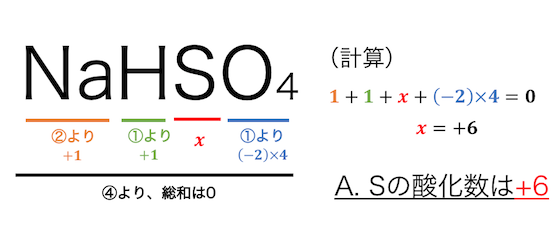
(2)NaHSO4 (S)
①より水素Hは+1、酸素Oは-2、
②よりアルカリ金属であるNaは+1、
④より総和は0だから、硫黄Sの酸化数は+6。
(3)MnO4– (Mn)
①より酸素Oは-2、④より総和は-1だから、
マンガンMnの酸化数は+7です。

(4)H2O2 (O)
①より酸素Oは-2のようだが、
①と④を利用すると酸素Oは-1。
このように競合した場合は⑤へ。
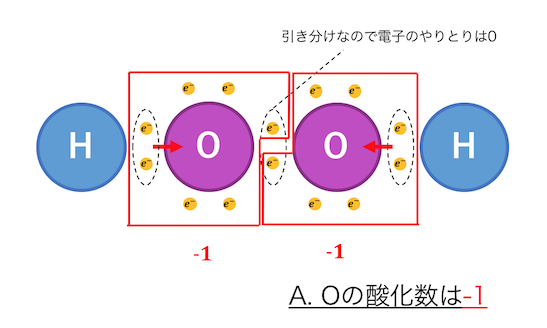
構造式から求める酸素Oの酸化数は-1。
(5)HClO (Cl)
よりハロゲンである塩素Clは-1のようだが、
①と④を利用すると塩素Clは+1。
このように競合した場合は⑤へ。
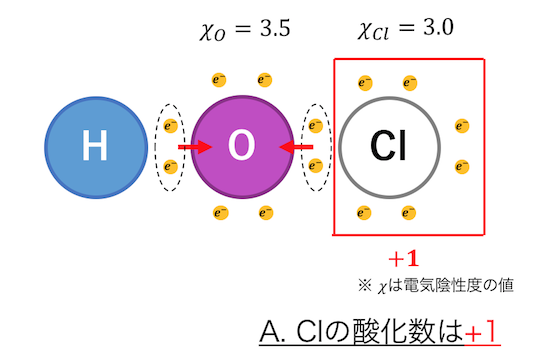
構造式から求める塩素Clの酸化数は+1。
(電気陰性度の序列)
F>O>Cl=N>C>H>金属元素
酸化還元反応の導入
「なぜ酸化数が必要なのか」を理解するために、
少しだけ酸化還元反応を先取りしてみます。
練習問題で酸化数を求めた、
過マンガン酸イオンMnO4–で考えてみましょう(硫酸酸性下で考えます)。
過マンガン酸イオンの中のマンガンは、
周りの酸素に電子を奪われて酸化数が+7となっていました。
普段Mn2+のイオンになりたがっているマンガンが、
+7まで電子を失っているわけです。
マンガンはこの酸化数の差を埋めるため、
周りから電子を奪いにかかります。
酸化数を+7→+2にしたいのですから、
電子を5個受け取るのは当然ですね。
さて、いくら電子が欲しいと言えども、
化学反応の前後で電荷が変化しているのはおかしいです。
この反応はH+がいっぱいな酸性下で起こっているので、
電荷の差を埋めるためにH+が巻き込まれます。
水溶液中の反応なので、
H+は最後には水になってしまいます。
以上のように、
普段よりも酸化数が変化してしまったときに、
それを元に戻そうとすることで酸化還元反応が起こっています。
酸化数が化学反応の駆動力になっているということですね。
酸化還元反応の仕組みを酸化数から理解しよう!
まとめ
酸化数は、
「どれだけ電子を取った/取られたか」
の値で、その正確な定義は、
「共有電子対を電気陰性度の大きい原子の方に移したときの、
単体の場合からの電荷の増減」
でした。
これを理解するだけで、
酸化数の求め方からその意味に至るまで、
深く理解できたのではないでしょうか。
また、実際に酸化数を求めるのには練習がいりますから、
「練習問題」のところを繰り返し復習してみてください。














コメントを書く