今回は周期表の解説です。
周期表は化学の基礎の基礎であり、
古代の錬金術から近代の研究までの叡智が詰まっています。
ただ語呂合わせで丸暗記するのもいいですが、
周期表の意味を考えてみるのも面白いと思います。
では解説していきます。
周期表とは
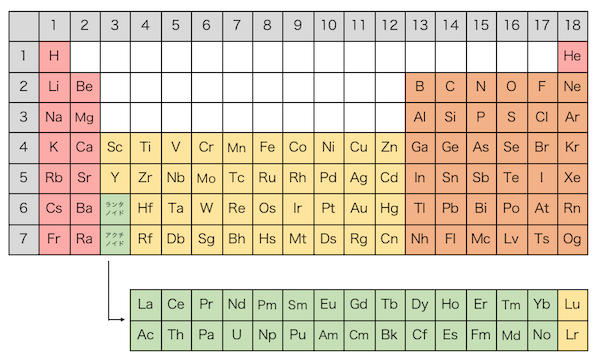
「周期表」とは、元素を原子番号順に並べた表です。
横の列のことを「周期」、縦の列のことを「族」といい、
同じ族に属する元素の性質は似ています。
ただ順番に並べただけで性質が似てくるというのは面白いですね。
このように元素の性質が一定の周期で変わることを、
元素の「周期律」といいます。
周期表の意味
周期表はどのような意味を持っているのでしょうか。
また、なぜ周期が生まれているのでしょうか。
メンデレーエフの時代とは違い現代は「電子配置」がわかっています。
電子配置に注目することで、
周期表の意味を読み取っていきましょう。
それでは解説していきます。
電子が元素に詰まるとき、
内側の電子殻から順番に、
より正確にはエネルギーの低い軌道から順に、
詰まっていくのでした。
このときの”最外軌道電子”ごとに色分けすると、
周期表は以下のようになります。
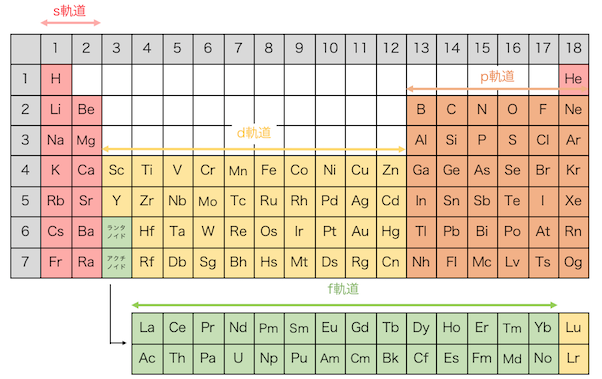
(※本当は”最外軌道電子”なんて言葉はないですが)
例えば1族は最外殻のs軌道に電子が1個の状態、
17族は最外殻のp軌道に電子が1個足りない状態です。
3-12族もd軌道の電子の数が一致しています。
同じ族が同じような化学的性質を持つのは、
当たり前に感じてきますね。
周期表内の元素の分類
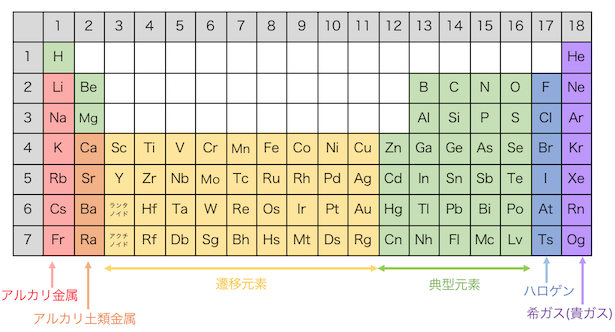
まず元素は大きく「典型元素」と「遷移元素」に分けられます。
典型元素は”最外軌道”がp軌道であり、
単純に最外殻に電子が詰まっていくため、
典型元素と呼ばれます。
一方d軌道やf軌道が”最外軌道”となり、
内側の電子殻に電子が入っていくのが遷移元素です。
12族はd軌道の最後の電子が詰まることで、内側の電子殻に電子が入る余地がなくなっています。だから典型元素として考えることができます。
また元素に周期が見つかる以前からの呼び名で、
Hを除く1族の元素を「アルカリ金属」、
Be、Mgを除く2族の元素を「アルカリ土類金属」、
17族の元素を「ハロゲン」、
18族の元素を「希ガス」と呼ぶことがります。。
例えばアルカリ金属は最外殻に1つの電子しかないため、
電子を放出しやすく非常に陽性が高いです。
一方でハロゲンは最外殻にあと1つ電子があると、
ちょうど軌道がいっぱいになるため、
電子を受け取る力、つまり陰性が強いです。
このようなわかりやすい性質から、
個別に名前が付いているのですね。
まとめ
今回は周期表を確認しました。
軌道を理解することで、
周期表をより深く理解できたのではないでしょうか。













周期表と電子配置のページにおいて、3-12族のd軌道の電子の数は一致している
と表記にありますがScとTiですら3d軌道に入っている電子の数は違うはずです。どのd軌道に入っている電子の数が一致しているのか御教授いただけると嬉しいです。もしや4d軌道でしょうか
コメントありがとうございます、確かに相当わかりにくい&誤解を招く表現でした…。
ここで伝えたかったことは、例えば3族に注目するとScは3dに1つ・Yは4dに1つ、4族に注目するとTiは3dに2つ・Zrは4dに2つというように、同じ族ではd軌道電子の数が同じになっているということでした(もちろん周期は違うので3dや4dの違いはありますが)。
高校レベルの一般的な話では、典型金属では「同じ族では最外殻電子数が同じだから性質が似ている」と教えるのに、遷移金属では「最外殻電子は(基本)2個だけどなぜか同じ族で性質が似ている」というようにしか教えられません。だから「軌道に注目すれば、実は遷移金属でもd軌道電子数に周期性があるから、やっぱり族ごとに似た性質がある」という雰囲気を伝えたいが為の記述でした。
だから「3-12族のd軌道の電子の数は一致している」という表記の真意は、「3-12族のd軌道の電子の数は、同じ族の中では(3d、4dなどの周期違いの差はあれ)一致している」というようなことです(これでも日本語が下手すぎますが…笑)。
記事の記述も、もう少し日本語を練って修正したいと思います。
Be Mgを除く2族元素がアルカリ金属になってますよ
わ、ほんとだ、ご指摘ありがとうございますm(__)m