今回は飽和蒸気圧の解説です。
飽和蒸気圧を理解するためには、
「気液平衡」の仕組みをきちんと理解しておく必要があります。
気液平衡をきちんと理解していないと、
センター試験の正誤問題などで意外と悩んでしまいます。
ここでは飽和蒸気圧について、
きちんと物理現象がイメージできるように解説します。
ここの内容をきちんと理解すれば、
気液平衡や飽和蒸気圧で何が起こっているかが、
絵に描いたように頭に浮かぶようになります。
問題を解く時の大きな助けになるでしょう。
それでは解説していきます。
目次
飽和蒸気圧とは
飽和蒸気圧を理解するためには、
「気液平衡」の仕組みを理解しておく必要があります。
まずは気液平衡から確認していきましょう。
気液平衡とは
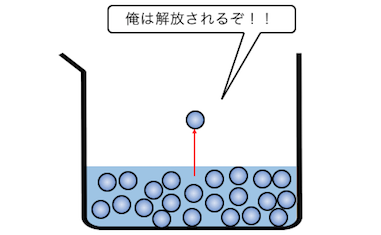
液体の中の分子は熱によって運動しています。
この運動のエネルギーが大きくなり、
分子間力を断ち切って外に飛び出すことで、
分子は気体となります。
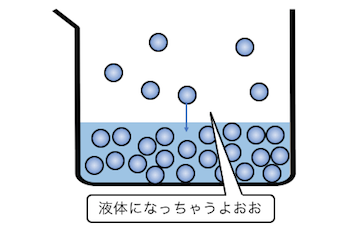
しかし逆に、
気体が運動エネルギーを失うと、
分子が液体に絡め取られてしまうこともあります。
それでは以下のように、
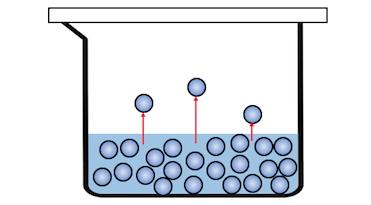
密閉容器に水を入れた場合を考えましょう。
最初のうちは気体の水がありませんから、
次々と気体に変わっていきます。
少しずつ気体が増えると、
徐々に気体から液体に戻る分子も現れます。
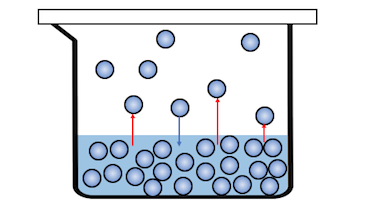
そしてついに気体から液体に変わる分子と、
液体から気体に変わる分子の数が釣り合うと、
「気液平衡」となります。
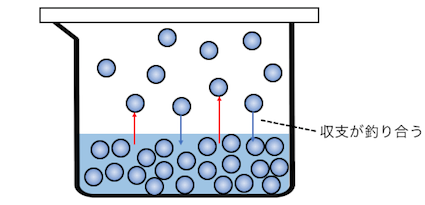
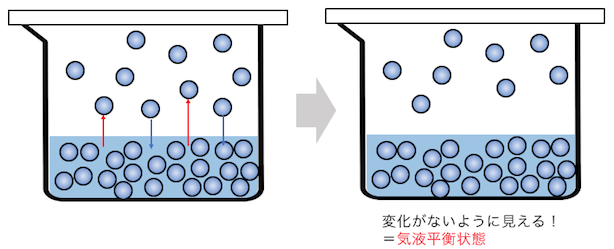
気液平衡では何も変化が起こっていないように見えるのです。
このように「本当は動いているけれど、全体は変わらない」が平衡状態です。
飽和蒸気圧の定義
気液平衡の状態では、
温度と体積が一定ならいつも決まったモル数が気体になります。
理想気体の状態方程式PV=nRTを思い出せば、
温度と体積が一定ならいつも決まった圧力
ということもできますね。
気液平衡状態での圧力のことを、
「飽和蒸気圧」といいます。
「モル数が一定なら”飽和物質量”でもよくない?」
と思う人もいるかもしれません。
以下の例を見てみましょう。
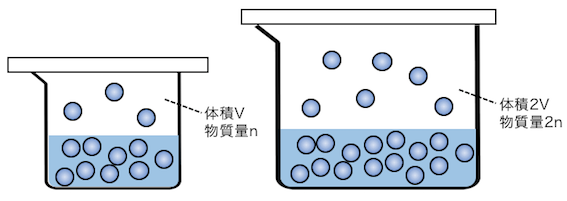
左の状態はV[L]の空間にn[mol]の気体が、
右の状態は2V[L]の空間に2n[mol]の気体があります。
このように体積を2倍にしてしまうと、
“飽和物質量”も2倍になってしまうのです。
ここで圧力を計算してみましょう。
飽和蒸気圧はどちらも同じですね。
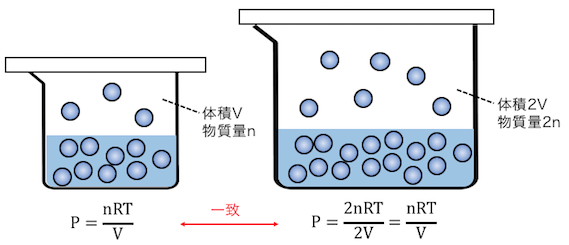
このように温度を決めれば、
飽和蒸気圧は1つに定まるため、
飽和蒸気圧で考えるのが便利なのです。
飽和蒸気圧の性質
飽和蒸気圧は気液平衡状態の気体の圧力でした。
飽和蒸気圧のイメージを固めるために、
いくつかの具体例を見ながら性質を確認していきましょう。
体積変化と飽和蒸気圧
ピストン付きの容器内で、
飽和状態になっているとしましょう。
このとき、
①体積一定で、温度を上げる
②温度一定で、体積を小さくする
③温度一定で、体積を大きくする
という操作をするとしましょう。
それぞれ飽和蒸気圧と物質量はどうなるでしょうか。
一度自分の頭の中で状態をイメージして、
それから以下を読んでください。
①体積一定で、温度を上げる
温度を上げると分子の運動エネルギーが大きくなります。
よって気体になる分子数が増えていきます。
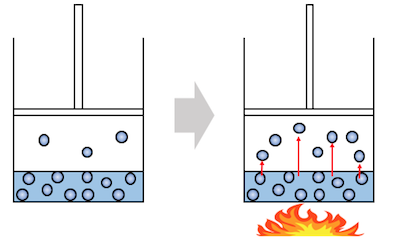
これによって飽和蒸気圧も大きくなります。
飽和蒸気圧を変化させるには、
このように温度を変化させれば良いのです。
結果的に飽和蒸気圧は上がり、物質量は増えました。
②温度一定で、体積を小さくする
体積を小さくすると、
ぎゅっと縮まって圧力が高くなりそうです。
しかし実際には、
圧力がかかればその分液体に押し込められ、
結局分子の数が減っていきます。
これによって飽和蒸気圧は一定に保たれます。
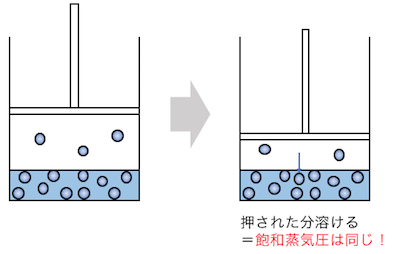
温度さえ変わらなければ圧力は変化しないのです。
結果的に飽和蒸気圧は一定で、物質量は減りました。
③温度一定で、体積を大きくする
ここまでくれば現象が頭に浮かんでいるでしょう。
体積を増やせば圧力が減りますが、
その分もっと気体になれますから、
どんどん分子の数が増えて圧力が元に戻ります。
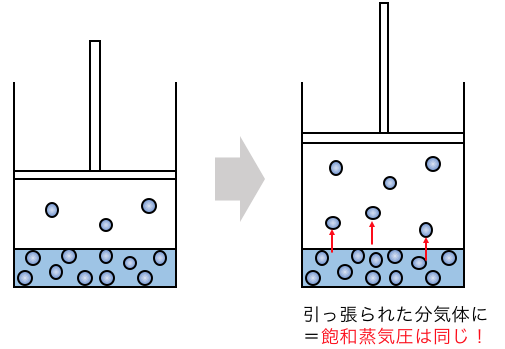
結果的に飽和蒸気圧は一定で、物質量は増えました。
蒸気圧曲線
ある物質の飽和蒸気圧は、
温度のみに依存することがわかったと思います。
飽和蒸気圧と温度の関係のグラフにしたものを、
「蒸気圧曲線」といいます。
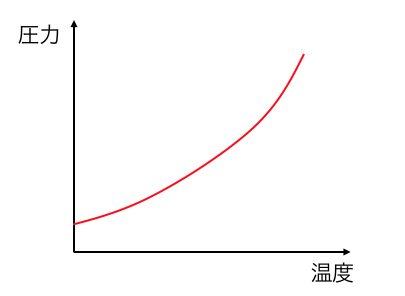
飽和蒸気圧は物質量や体積には関係なく、
ただ温度だけによって決定されるのですね。
ちなみに蒸気圧曲線は、
状態図の一部を切り取ったものです。
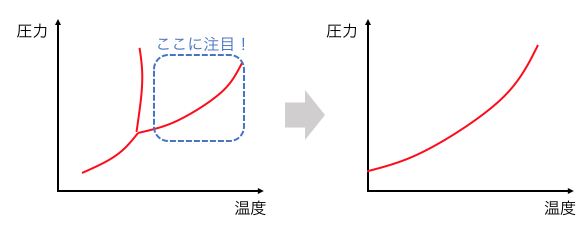
実は新しく覚えることは何もないのですね。
参考:密閉容器だと沸騰しない!?
密閉容器に水と空気を入れて温めてみましょう。
まずは水が沸騰する100℃まで温度を上げてみます。
すると水の飽和蒸気圧は1atmになり、
空気と合わせると2atmになります。
沸騰とは飽和蒸気圧が外の圧力を超えると起こりますが、
飽和蒸気圧1atm>外の圧力2atmで沸騰しません。
では飽和蒸気圧が2atmになるまで温めてみましょう。
飽和蒸気圧は2atmになりますが、
外の圧力も3atmになってしまいます。
となると、
飽和蒸気圧が100atmや1000atmになっても、
その分外の圧力が101atmや1001atmになってしまい、
いつまでたっても沸騰しないということになります。
何100℃、何1000℃に加熱しても沸騰しないのは、
なんとなく面白いですね。
まとめ
今回は飽和蒸気圧の解説でした。
物理現象として何が起こっているかが、
頭でイメージできるようになったでしょうか?
きちんと現象を理解してしまえば、
飽和蒸気圧の問題の計算の部分はおまけに思えてきます。
きちんと復習しておきましょう。














飽和蒸気圧の説明を拝見させて頂きました。ありがとうございました。
今、資格試験の勉強をしているのですが飽和蒸気圧が高い物質の方が、低い物質よりも沸点は低いと解説にありますが、理解できません。
ご教授願えますか?
コメントありがとうございます。
まず先に補足しておきたいのですが、飽和蒸気圧は温度の関数です。つまり「飽和蒸気圧が高い物質の方が、低い物質より」というのは、より正確にいえば「同じ温度で比べたとき〜」という文言を付け加えた方がいいかもしれません(記事の方が説明不足ですね…)。
次に沸点とは「飽和蒸気圧と大気圧が一致するときの温度」のことです。飽和蒸気圧は温度を上げるほど大きくなる関数ですが、どんどん温度を上げていって飽和蒸気圧が上がっていった時に、飽和蒸気圧が大気圧に一致したときの温度が沸点です。
では本題に移ります。ここでは具体例としてエタノールと水を考えましょう。温度20℃ではエタノールの飽和蒸気圧は0.050atm、水の飽和蒸気圧は0.023atmです。つまり同じ温度20℃ではエタノールの方が飽和蒸気圧が高いということです。その状態から温度を上げていけば両方飽和蒸気圧は高くなっていくわけですが、20℃の時点で飽和蒸気圧が高かったエタノールの方が先に大気圧1atmにたどり着きそうですよね。そのイメージ通り、エタノールは約80℃で飽和蒸気圧が1atmに達するので沸点は約80℃になります。水は80℃ではまだ0.47atmにしかならず、100℃になってようやく1atmになり沸点となります。
以上をまとめれば、同じ温度で飽和蒸気圧が高い物質の方が、スタート地点が1atmに近い分早く1atmに辿り着きやすい、だから沸点が低い、ということになります。
資格試験に受験メモの記事を使っていただきとても嬉しいです、資格試験の勉強、頑張ってください〜。
高1です。
化学を先取りしようとして教科書を読んでいたのですが、蒸気圧や蒸気圧曲線がよく理解できず、このサイトを拝見しました。
とてもわかりやすく、大変参考になりました。
ありがとうございました
ただ最後の、参考の、
すると水の飽和蒸気圧は1atmになり、
空気と合わせると2atmになります。(引用)
というところが、納得できません。
この、空気は、密閉した容器内の空気のことですよね…?
どうして1atmだとわかるのですか?
それと、空気と合わせた、2atmというのは、
外の圧力、なのですか?外の圧力というのは、密閉した容器の外側からの圧力という解釈で正しいのでしょうか?
初歩的なことですみません
教えていただけると、とても嬉しいです!
よろしくお願いします!
確かにここはかなりわかりにくい表現になってしまってましたね…。少し補足の説明をしたいと思います。
まず鍋に水を少し入れて、蓋をした場合を考えてみましょう。
蓋をする前と後で鍋の中の空気は変化しないので、大気圧が1atmなら鍋の中の空気も1atmです。
さて、この状態で十分な時間待つと、気液平衡で水蒸気圧が生じてきます。
仮に水蒸気圧が0.2atmだったなら、鍋の中の全圧は1.2atmになるわけです。
文中で言っている「外の圧力」とは、
水に対しての外の圧力、つまり、
鍋の内側の空間の全圧(空気の圧力+水蒸気圧)を指しています。
(ここがわかりにくい書き方でしたね。)
このとき鍋の外の圧力は1atmのままです。鍋の内側だけ1.2atmになっているんだから、もし蓋が0kgだったら蓋は飛ばされてしまいます。
しかし実際には鍋の蓋には重さがあるので、鍋の中が1.2atmになったからって蓋が外れることはありません。
そしてこの状態で鍋を火にかけてみましょう。現実的にはこの火で鍋の中の水と空気が温められますが、わかりやすさのために水だけが温められると考えてください。
すると温められた水は飽和蒸気圧が上がりますが、空気には何の変化もないので1atmのままです。だから、水の飽和蒸気圧が1atmになったなら全圧は1+1=2atm、10atmになったなら全圧は10+1=11atmとなるわけです。
そしてもちろん、この間で鍋の外は常に1atmです。
【もっと細かい補足】
しかし実際には空気も温められて膨張するはずなので、鍋の中の空気の圧力も1atmより大きくなります。ただ今回は一旦無視してしまっています。
またこの実験を実際にやるといつか事故が起きます。鍋の中の圧力が大きくなっていってある大きさを超えると、蓋の重さでは耐えきれなくなって蓋が吹っ飛ぶからです。
だから実際に実験をするには、ものすごく頑丈な鍋を用意して、ものすごい力で蓋を押さえつける必要があります。
相当説明がごちゃごちゃしてしまいました 笑
説明の中でわからないことがあったらまた返信をお願いしますー。